Tinjauan Ulang Tentang Atom dan Molekul dalam Kimia Organik
TINJAUAN ULANG TENTANG ATOM DAN MOLEKUL DALAM KIMIA ORGANIK

Tahukah kamu apakah kimia organik itu? Mengapa kita perlu mempelajarinya? Jawabannya sederhana, kimia organik merupakan salah satu cabang ilmu kimia yang mempelajari tentang struktur, sifat, komposisi, reaksi, serta sintesis senyawa organik. Kita perlu mempelajarinya karena semua organisme hidup tersusun atas senyawa-senyawa organik.
A. Struktur Elektron dari Atom

Teori Atom Dalton
John Dalton (1776 – 1844), mengemukakan teori atom berdasarkan dua hukum, yaitu hukum kekekalan massa (berbunyi: massa zat sebelum dan sesudah reaksi sama) dan hukum perbandingan tetap (berbunyi: perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap dan tertentu).
 |
| Teori Atom Dalton |
- Materi tersusun atas partikel-partikel sangat padat dan kecil yang tidak dapat dipecah-pecah lagi. Partikel itu dinamakan atom.
- Atom-atom suatu unsur identik dalam segala hal, tetapi berbeda dengan atom-atom unsur lain.
- Dalam reaksi kimia, terjadi penggabungan atau pemisahan dan penataan ulang atom-atom dari satu komposisi ke komposisi lain.
- Atom dapat bergabung dengan atom lain membentuk suatu molekul.
Pada tahun 1897 Joseph John Thomson menemukan partikel bermuatan listrik
negatif yang kemudian disebut elektron. Berdasarkan penemuannya
tersebut, kemudian Thomson mengajukan teori atom baru yang dikenal
dengan sebutan teori atom Thomson.
 |
| Teori atom Thomson |
Elektron-elektron dalam atom diumpamakan seperti butiran kismis dalam
roti, maka Teori Atom Thomson juga sering dikenal dengan Teori Atom Roti
Kismis.
Teori Atom Rutherford
Pada tahun 1908, Rutherford yang dibantu oleh dua muridnya, Hans Geiger
dan Ernest Marsden, melakukan eksperimen dengan menembakkan sinar alfa
(sinar bermuatan positif) pada pelat emas yang sangat tipis. Berdasarkan
percobaan tersebut, Rutherford menyusun suatu teori atom untuk
menyempurnakan teori atom Thomson. Teori yang dikembangkan oleh
Rutherford adalah sebagai berikut:
 |
| Teori atom Rutherford |
- Atom tersusun atas inti atom yang bermuatan positif dan elektronelektron yang bermuatan negatif.
- Sebagian besar volume atom merupakan ruang kosong yang massanya terpusat pada inti atom.
- Oleh karena atom bersifat netral maka jumlah muatan positif harus sama dengan jumlah muatan negatif.
- Di dalam atom, elektron-elektron bermuatan negatif selalu bergerak mengelilingi inti atom.
Teori Atom Bohr
Pada 1913 Niels Bohr menyatakan bahwa kegagalan teori atom Rutherford
dapat disempurnakan dengan menerapkan Teori Kuantum dari Planck.
 |
| Teori atom Bohr |
- Dalam mengelilingi inti atom, elektron berada pada kulit (lintasan) tertentu. Kulit ini merupakan gerakan stasioner (menetap) dari elektron dalam mengelilingi inti atom dengan jarak tertentu.
- Selama elektron berada pada lintasan stasioner tertentu, energi elektron tetap sehingga tidak ada energi yang diemisikan atau diserap.
- Elektron dapat beralih dari satu kulit ke kulit lain. Pada peralihan ini, besarnya energi yang terlibat sama dengan persamaan Planck, ΔE = h.
- Lintasan stasioner elektron memiliki momentum sudut. Besarnya momentum sudut adalah kelipatan dari nh/2π, dengan n adalah bilangan kuantum dan h adalah tetapan Planck.
Teori atom Bohr ditunjukkan pada gambar di atas. Huruf K, L, M, dan
seterusnya digunakan untuk menyatakan lintasan elektron dalam
mengelilingi inti atom. Lintasan dengan n = 1 disebut kulit K, lintasan
dengan n = 2 disebut kulit L, dan seterusnya.
Atom terdiri dari nukleus dengan muatan positif yang dikelilingi muatan negatif dari elektron pada jarak yang relatif jauh. Nukleus terdiri atas partikel subatomik yang disebut neutron, bermuatan netral, dan proton, bermuatan positif. Meskipun memiliki diameter yang sangat kecil, nukleus berperan penting terhadap semua massa dari atom. Elektron memiliki massa yang dapat diabaikan dan mengelilingi nukleus.
Susunan Elektron dalam Atom dapat dijelaskan menggunakan konfigurasi
elektron. Penyusunannya dalam Atom didasarkan pada teori-teori tertentu
yaitu diantaranya adalah Teori Dualisme Gelombang Partikel, Azas
ketidakpastian, dan Teori Persamaan Gelombang. Teori Dualisme gelombang
partikel yang dikemukaan oleh De Broglie pada tahun 1924, teori ini
menyatakan elektron dalam atom bersifat gelombang dan partikel. Azas
Ketidakpastian yang dikemukakan oleh Heisenberg pada tahun 1927,
menyatakan bahwa posisi dan momentum partikel tidak dapat ditentukan
secara pasti dalam waktu bersamaan. Teori ini menyimpulkan bahwa
lintasan elektron tidak berbentuk lingkaran. Dan Teori Persamaan
Gelombang yang diemukakan oleh Erwin Schrodinger, menerangkan bahwa
pergerakan partikel-partikel mikroskopik termasuk Elektron.
Azas Ketidakpastia menurut Heisenberg, menyebabkan posisi elektron tidak
ditentukan dengan pasti demikian pula dengan elektron dalam atom
menurut Mekanika Kuantum. Walaupun orbit elektron tidak dapat ditentukan
dengan pasti, tetapi peluang untuk menentukan elektron pada posisi
tertentu disekitar inti masih mungkin untuk ditentukan. Orbital
merupakan daerah disekitar inti dengan peluang terbesar untuk menetukan
elektron. Kapasitas maksimal orbital untuk ditempati elektron sebesar 2
elektron. Orbital juga ini sering disebut tingkat energi. Hanya elektron
dengan energi yang cocok dapat menempati orbital tersebut. Berikut susunan elektron dari beberapa unsur.
B. Jari-jari Atom dan Keelektronegatifan
- Jari-jari atom
Jari-jari atom merupakan jarak elektron terluar ke inti atom dan menunjukkan ukuran suatu atom. Jari-jari atom sukar diukur sehingga pengukuran jari-jari atom dilakukan dengan cara mengukur jarak inti antar dua atom yang berikatan sesamanya. Dalam suatu golongan, jari-jari atom semakin ke atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas, kulit elektron semakin kecil. Dalam suatu periode, semakin ke kanan jari-jari atom cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi elektron tetap sama sehingga tarikan inti terhadap elektron terluar semakin kuat.

Jari-jari atom ditentukan dengan mengukur panjang ikatan (jarak antar inti) dalam senyawa. Jari-jari atom sangat kecil, diduga diameternya sekitar 10- m. Satuan yang biasa digunakan untuk menyatakan jari-jari atom adalah angstrom [Å].
Jari-jari atom berubah-ubah bergantung pada besarnya tarikan antara inti dengan elektronnya. Makin besar tarikan, makin kecil jari-jari atomnya. Tarikan inti terhadap elektron dipengaruhi oleh jumlah proton dalam inti dan jumlah kulit yang mengandung elektron. Inti dengan jumlah proton yang lebih banyak mempunyai tarikan yang lebih besar terhadap elektron-elektronnya. Penurunan jari-jari atom dari kiri ke kanan dalam periode yang sama disebabkan bertambahnya jumlah proton didalam inti atom, sedangkan jumlah orbitalnya sama. Dengan bertambahnya jumlah proton, tarikan inti terhadap elektron valensi semakin kuat sehingga terjadi pengerutan volume atom.
- Keelektronegatifan
Besarnya kenegatifan (elektron) yang didefinisikan dengan keelektronegatifan, yang merupakan ukuran kemampuan atom mengikat elektron. Kimiawan dari Amerika, Robert Sanderson Mulliken (1896-1986) mendefinisikan keelektronegatifan sebanding dengan rata-rata aritmatik energi ionisasi dan afinitas elektron.
Keelektronegatifan adalah kemampuan suatu unsur untuk menarik elektron dalam molekul suatu
senyawa. Harga keelektronegatifan ini diukur dengan menggunakan skala Pauling yang besarnya
antara 0,7 sampai 4. Unsur yang mempunyai harga keelektronegatifan besar, cenderung
menerima elektron dan akan membentuk ion negatif. Sedangkan unsur yang mempunyai harga
keelektronegatifan kecil, cenderung melepaskan elektron dan akan membentuk ion positif.
Dalam satu golongan (dari atas ke bawah), harga keelektronegatifan semakin kecil. Dan dalam
satu periode (dari kiri ke kanan), harga keelektronegatifan semakin besar. Berikut contohnya :

C. Panjang Ikatan dan Sudut Ikatan
- Panjang ikatan (bond lenght)
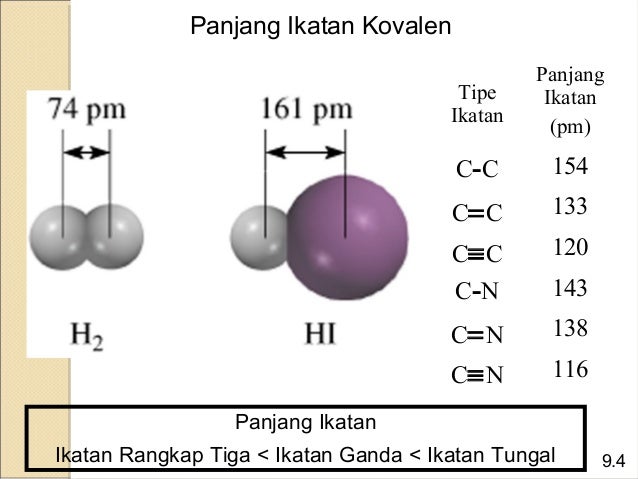
Dalam struktul molekul, ada beberapa sifat ikatan didalamnya. Jarak yang memisahkan inti dari dua atom yang terikat kovalen disebut panjang ikatan. Panjang ikatan (bond lenght) yaitu jarak antara inti-inti atom yang berikatan. Menurut Petrucci (2007:34), panjang ikatan (bond lenght) adalah jarak antara pusat-pusat dua atom yang dihubungkan oleh ikatan kovalen. Panjang ikatan kovalen antara dua atom dapat diperkirakan sebagai jumlah jari-jari kovalen dari kedua atom tersebut.
Panjang ikatan rangkap tiga lebih pendek daripada panjang ikatan rangkap dua
dan rangkap tunggal. Panjang ikatan rangkap dua lebih pendek daripada panjang
ikatan tunggal. Dan ikatan C dan H lebih pendek daripada ikatan C dengan C.
Panjang dan kekuatan suatu ikatan tergantung dari hibridisasi dati atom yang
saling berikatan. Semakin besar karakter s dalam orbital yang digunakan
atom-atom untuk membentuk ikatan, semakin pendek dan kuat ikatan tersebut.
Panjang ikatan dinyatakan dalam picometer (pm) atau bisa juga dinyatakan dalam Ȧ. Panjang ikatan dapat ditentukan secara eksperimental, mempunyai selang harga dari 0,74 Ȧ sampai 2 Ȧ.
- Sudut ikatan (bond angle)
Menurut Petrucci (2007:24), sudut ikatan (bond angle) yaitu sudut antara garis-garis bersebelahan yang mewakili ikatan. Bila ada lebih dari dua atom dalam molekul, ikatan membentuk sudut, yang disebut sudut ikatan. Berikut uraian contohnya.

D. Energi Disosiasi
Energi ikatan adalah kalor yang diperlukan untuk
memutuskan ikatan oleh satu mol molekul gas menjadi atom – atom atau
gugus dalam keadaan gas disebut. Energi disosiasi
ikatan adalah energi yang diperlukan untuk memutuskan salah satu ikatan 1
mol suatu molekul gas menjadi gugus – gugus molekul gas.
Contoh
CH4(g) → CH3(g) + H(g) ∆H = +425 kJ/mol
CH3(g) → CH2(g) + H(g) ∆H = +480 kJ/mol
Reaksi tersebut menunjukan bahwa untuk memutuskan sebuah ikatan C – H dari molekul CH4 menjadi gugus CH3 dan atom gas H diperlukan energi sebesar 425 kJ/mol, tetapi pada pemutusan C – H pada gugus CH3 menjadi gugus CH2
dan sebuah atom gas H diperlukan energi yang lebih besar, yaitu 480
kJ/mol. Jadi meskipun jenis ikatannya sama tetapi dari gugus yang
berbeda diperlukan energi yang berbeda pula.

E. Konsep Asam dan Basa dalam Kimia Organik
Asam dan basa adalah dua golongan zat kimia yang sangat
umum ditemukan di sekitar kita. Sebagai contoh, cuka, asam sitrun, dan
asam dalam lambung tergolong asam, sedangkan kapur sirih dan soda api
tergolong basa. Asam dan basa memiliki sifat-sifat yang berbeda. Pada
mulanya, asam dan basa dibedakan berdasarkan rasanya, di mana asam
terasa masam sedangkan basa terasa pahit dan licin seperti sabun. Namun,
secara umum zat-zat asam maupun basa bersifat korosif dan beracun —
khususnya dalam bentuk larutan dengan kadar tinggi — sehingga sangat
berbahaya jika diuji sifatnya dengan metode merasakannya.
- Teori Asam Basa Arrhenius
Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu:
- asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H+.
- basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH−.
2. Teori Asam Basa Brønsted–Lowry
Pada tahun 1923, Johannes N. Brønsted dan Thomas M. Lowry secara terpisah mengajukan definisi asam dan basa yang lebih luas. Konsep yang diajukan tersebut didasarkan pada fakta bahwa reaksi asam–basa melibatkan transfer proton (ion H+) dari satu zat ke zat lainnya. Proses transfer proton ini selalu melibatkan asam sebagai pemberi/donor proton dan basa sebagai penerima/akseptor proton. Jadi, menurut definisi asam basa Brønsted–Lowry,
- asam adalah donor proton.
- basa adalah akseptor proton.
HCl(aq) + H2O(l) → Cl−(aq) + H3O+(aq)
HCl berubah menjadi ion Cl− setelah memberikan proton (H+) kepada H2O. H2O menerima proton dengan menggunakan sepasang elektron bebas pada atom O untuk berikatan dengan H+ sehingga terbentuk ion hidronium (H3O+).Sedangkan pada reaksi ionisasi NH3 ketika dilarutkan dalam air, NH3 berperan sebagai basa dan H2O sebagai asam.
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
NH3 menerima proton (H+) dari H2O dengan menggunakan sepasang elektron bebas pada atom N untuk berikatan dengan H+ sehingga terbentuk ion ammonium (NH4+). H2O berubah menjadi ion OH− setelah memberikan proton (H+) kepada NH3.
Pelarutan
asam atau basa dalam air sebagai reaksi asam–basa Brønsted–Lowry
(Sumber: Silberberg, Martin S. & Amateis, Patricia. 2015. Chemistry:
The Molecular Nature of Matter and Change (7th edition). New York:
McGraw-Hill Education)
Kelebihan definisi oleh Brønsted–Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam–basa dalam fase gas, padat, cair, larutan dengan pelarut selain air, ataupun campuran heterogen. Sebagai contoh, reaksi antara gas NH3 (basa) dan gas HCl (asam) membentuk asap NH4Cl.
NH3(g) + HCl(g) → NH4Cl(s)
Beberapa zat dapat bertindak sebagai asam, namun juga dapat sebagai basa pada reaksi yang lain, misalnya H2O, HCO3−, dan H2PO4−. Zat demikian disebut amfiprotik. Suatu zat amfiprotik (misalnya H2O) akan bertindak sebagai asam bila direaksikan dengan zat yang lebih basa darinya (misalnya NH3) dan bertindak sebagai basa bila direaksikan dengan zat yang lebih asam darinya (misalnya HCl).3. Teori Asam Basa Lewis
Pada tahun 1923, G. N. Lewis mengemukakan teori asam basa yang lebih luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan elektron yang berkaitan dengan struktur dan ikatan. Menurut definisi asam basa Lewis,
- asam adalah akseptor pasangan elektron.
- basa adalah donor pasangan elektron.

Kelebihan definisi asam basa Lewis adalah dapat menjelaskan reaksi-reaksi asam–basa lain dalam fase padat, gas, dan medium pelarut selain air yang tidak melibatkan transfer proton. Misalnya, reaksi-reaksi antara oksida asam (misalnya CO2 dan SO2) dengan oksida basa (misalnya MgO dan CaO), reaksi-reaksi pembentukan ion kompleks seperti [Fe(CN)6]3−, [Al(H2O)6]3+, dan [Cu(NH3)4]2+, dan sebagian reaksi dalam kimia organik.

DAFTAR PUSTAKA
http://www.academia.edu/7572969/KIMIA_ORGANIK_I
http://www.studiobelajar.com/teori-asam-basa/
http://edu.anashir.com/2015/01/perkembangan-teori-atom.html
http://www.academia.edu/6792730/Intramolekul-panjang_dan_sudut_ikatan
https://memomasbunpane46.blogspot.co.id/2016/09/normal-0-false-false-false-en-us-x-none.html
Permasalahan : Mengapa posisi elektron tidak dapat di tentukan secara pasti? Bagaimana cara kita mengidentifikasi keberadaan suatu elektron?
Permasalahan : Mengapa posisi elektron tidak dapat di tentukan secara pasti? Bagaimana cara kita mengidentifikasi keberadaan suatu elektron?


Terima kasih infonya, saya ingin bertanya. Mengapa dalam suatu atom, elektron yang berada disekitar atom tidak jatuh ke dalam elektron? Bisa tolong di jelaskan?
BalasHapusMungkin maksud pertanyaan anda mengapa dalam satu atom, elektron yang berada disekitar inti atom tidak jatuh ke dalam inti atom tersebut. Hal ini terjadi dikarenakan beberapa hal berikut:
Hapus1. Jarak inti atom dengan elektron lebih besar dari jari-jari inti atom
2. Untuk berada didalam inti atom, diperlukan energi minimum yang sesuai dengan panjang gelombang maksimumnya. Namun elektron tidak dapat memenuhi ketentuan tersebut.
3. Apabila elektron berada di dalam inti, maka orde momen magnetik elektron harus sama dengan orde momen magnetik proton. Kenyataannya momen magnetik inti yang teramati adalah tidak sama dengan momen magnetik proton.
Man Satu orbital hanya mampu menampung dua elektron. bisakah anda berikan penjelasan lebih rinci mengenai pernyataan tersebut ? terima kasih.
BalasHapusAda sebuah aturan yang dikemukakan oleh Wolfgang Pauli pada tahun 1926. Yang menyatakan “Tidak boleh terdapat dua elektron dalam satu atom dengan empat bilangan kuantum yang sama”. Orbital yang sama akan mempunyai bilangan kuantum n, l, m, yang sama tetapi yang membedakan hanya bilangan kuantum spin (s). Dengan demikian, setiap orbital hanya dapat berisi 2 elektron dengan spin (arah putar) yang berlawanan. Jadi, satu orbital dapat ditempati maksimum oleh dua elektron, karena jika elektron ketiga dimasukkan maka akan memiliki spin yang sama dengan salah satu elektron sebelumnya.
HapusContoh :
Pada orbital 1s, akan ditempati oleh 2 elektron, yaitu :
Elektron Pertama à n=1, l=0, m=0, s= +½
Elektron Kedua à n=1, l=0, m=0, s= – ½
(Hal ini membuktikan bahwa walaupun kedua elektron mempunyai n,l dan m yang sama tetapi mempunyai spin yang berbeda)
Mengapa ikatan C dan H lebih pendek daripada ikatan C dan C? Mohon jelaskan.
BalasHapusPanjang ikatan adalah jarak antara dua buah atom yang saling berikatan atau jarak rata-rata antar dua buah inti yang berikatan kovalen. Ikatan C dengan H lebih pendek dari ikatan tunggal antara C dengan C.
HapusPanjang dan kekuatan suatu ikatan tergantung dari hibridisasi dari atom yang saling berikatan. Semakin besar karakter s dalam orbital yang digunakan atom-atom untuk membentuk ikatan, semakin pendek dan kuat ikatan tersebut.
Panjang ikatan dalam suatau molekul antara suatu atom dengan atom yang lain dipengaruhi oleh beberapa hal yaitu:
1. Jari-Jari Kovalen
Jari-jari kovalen adalah setengah dari jarak antara dua inti atom homonuklear yang berikatan kovalen atau setengah dari jarak ikatan antara dua atom yang sama.Perbedaan panjang ikatan dalam ikatan antar molekul karena perbedaan pada nomor atom dalam molekul-molekul tersebut. Jika nomor atom dalam suatu molekul semakin besar maka semakin besar jari-jari atomnya. Seperti yang kita ketahui, nomor atom H = 1, sedangkan nomor atom C = 6. Hal inilah yang menyebabkan ikatan C dengan H lebih pendek dari ikatan tunggal antara C dengan C. Semakin besar nomor atom maka semakin besar juga jari-jari atomnya,Dalam satu golongan(dari atas kebawah jari-jari atom semakin bertambah,hal ini dikarenakan jumlah kulit elektron bertambah dan karenannya jari-jari atom bertambah juga,maka panjang ikatan otomatis akan semakin besar.contoh:dalam tabel diatas kita dapat mengetahui perbandingan panjang ikatan dengan melihat molekul HF,HCl,HBr,HI.Hal yang berbeda terjadi dalam satu periode yaitu jari-jari atom akan semakin mengecil,hal ini disebabkan karena semakin bertambahnya proton namun kulit atom tidak bertambah maka gaya tarik ke inti akan semakin kuat yang menyebabkan ikatan semakin pendek.contoh dalam tabel adalah NH3,HF,H2O.panjang ikatan antara N-H lebih pendek dibandingkan dengan H-F,namun panjang ikatan antara H-O lebih pendek dari H-F padahal unsur F berada di sebelah kanan unsur F dan mempunyai kelektronegatifan lebih besar,otomatis seharusnya ikatan antara H-F lebih panjang dibandingkan H-O.Hal ini dipengaruhi karena dalam molekul H2O memiliki 2 pasang elektron bebas pada atom sentral yaitu unsur O,berdasarkan teori VSEPR elektron bebas akan saling tolak menolak sehingga menyebabkan sudut dan panjang ikatan semakin kecil
2. Keelektronegatifan
Panjang ikatan di pengaruhi oleh keelektronegatifan ,untuk ikatan yang dibentuk dari atom-atom yang memiliki perbedaan keelektronegatifan, rumus Pauling dan Huggins tidak dapat diterapkan.Kenyataan memberi petunjuk bahwa panjang ikatan seperti ini selalu lebih pendek daripada jumlah jari-jari atom pembentuknya. Hal ini terjadi karena adanya kontraksi akibat perbedaan keelektronegatifan polaritas.Termasuk panjang ikatan H-X (X=Halida) karena perbedaan keelektronegatifan.
3.Orde ikatan(jumlah ikatan)
Panjang ikatan berkurang dengan bertambahnya orde ikatan.Makin tinggi orde ikatan,maka ikatannya semakin pendek,sebaliknya.Namun makin tinggi orde ikatan suatu ikatan molekul,maka ikatan yang terjadi di antara molekul semakin kuat. pada umumnya ikatan rangkap lebih kecil ikatannya dari ikatan tunggal. Bandingkan ikatan antara C=O dengan C-Cl,walaupun Cl lebih elektronegatif dari pada O tetapi C=O memiliki orde ikatan 2 yang menyebabkan panjang ikatannya lebih pendek.
4.Hiperkonjungsi:Meliputi pergeseran ikatan phi,elektron bebas dan elektron ikatan sigma,efek hiperkonjungsi ini lebih lemah daripada resonansi.
Apakah ada prsmaan antara asam dan basa?
BalasHapusKeduanya merupakan larutan elektrolit, artinya dalam larutannya akan terurai menjadi ion positif dan negatif sebagai pembawa muatan listrik.
HapusSaya mencoba menambah jawaban dari sodari nia yaitu soal dari sodari fania
HapusAda yaitu Persamaan:
- Bersifat konduktor listrik
- Bersifat korosif terhadap logam
Saya mencoba menambah jawaban dari sodari nia yaitu soal dari sodari fania
HapusAda yaitu Persamaan:
- Bersifat konduktor listrik
- Bersifat korosif terhadap logam
bagaimana proses tahapan pemutusan ikatan heterolitik?
BalasHapusPemutusan ikatan heterolitik adalah pemutusan yang terjadi pada senyawa polar dimana unsur-unsur yang berikatan memiliki perbedaan kelektronegatifan yang relatif besar. Ketika senyawa polar AB mengalami pemutusan ikatan, maka unsur yang memiliki keelektronegatifan paling besar akan membawa elektron ikatan. Pemutusan dengan cara ini mengasilkan ion.
BalasHapusPemecahan heterolisis yaitu pembelahan ikatan kovalen dengan salah satu pecahan mengambil kedua elektron (sepasang), sedangkan yang lainnya tidak medapatkan elektron. Hasilnya adalah dua buah partikel yang bermuatan. Hasil pemecahan heterolisis adalah dua buah ion, yaitu anion (bermuatan negatif) dan kation (bermuatan positif).
Reaksi pemutusan heterolitik sebagai berikut :
Pemutusan heterolitik yang diberi tanda panah untuk menyatakan perpindahan sepasang electron.
Dalam pemutusan ikatan kimia, electron yang paling mudah lepas adalah :
a. Ikatan sigma ( C-C ) lebih mudah lepas daripada ikatan C-H, missal pada alkana
b. Ikatan phi dari ikatan rangkap dua daripada ikatan rangkap tiga.
c. Electron pada atom-atom oksigen, nitrogen, dan halogen.