HIBRIDISASI KARBON, NITROGEN, DAN OKSIGEN
Hibridisasi
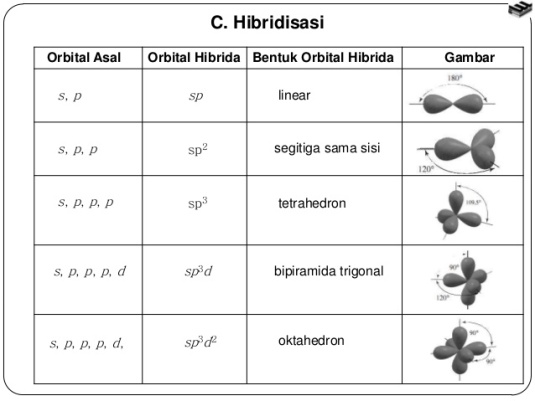
Hibridsasi adalah penggabungan beberapa orbital dari atom – atom yang berikatan
Hibridisasi adalah penggabungan beberapa orbital dari atom – atom yang berikatan dan ditata ulang
sehingga membentuk orbital baru dengan tingkat energi yang sama.
Aturan dalam proses hibridisasi :
- Penghibridisasian adalah proses orbital pada satu atom (atau ion). Sebaliknya, pembentukan orbital molekul memerlukan pencampuran orbital yang semula berpusat pada atom yang berbeda (atom sejenis atau tidak sejenis).
- Hanya orbital yang energinya berdekatan yang dicampur membentuk hibrida yang baik. Untuk tujuan ini, orbital yang dimaksudkan ialah yang tergolong ke dalam ‘golongan energi’ yang sama.
- Banyaknya orbital yang dicampurkan selalu sama dengan banyaknya hibrida yang diperoleh.
- Dalam penghibridaan, kita mencampur sejumlah orbital, bukan sejumlah elektron. Misalnya, jika kita ingin membentuk hibrida dwigonal (sp) pada atom dengan konfigurasi tiga-elektron, 2s2 2p1, maka kita campurkan orbital s dan p untuk mendapatkan dua hibrida ф1 ф2 dan kemudian menata elektron kedalamnya, mungkin menjadi ф12 ф21.
- Segera setelah orbital digunakan untuk membangun hibrida, orbital ini tidak lagi tersedia untuk ditempati elektron dalam bentuk ‘murni’, karena orbital 2s tidak lagi dalam keadaan itu.
- Kebanyakan hibrida bersifat sama, tetapi tidak selalu sama; perbedaannya satu sama lain terutama pada orientasinya dalam ruang. Gambaran yang benar untuk hibrida sp dalam penampang lintangnya disajaikan pada gambar 4.12.bentuk tiga dimensi dibuat diruang dengan memutar sumbu z tanpa tranlasi, jadi cukup memutarnya dengan jari.
- Karena orbital s tidak mempunyai arah dalam bidang xyz, maka orbital ini tidak mnambah arah dalam pembentukan hibrida. Orbital s hanya menanmbah ‘gemuk’.
- Orbital lain yang arahnya jelas di ruang (px, pz, dxy, dyz, dan lain-lain) menentukan arah hibrida. Mencampur orbital dekat-x dan dekat-y dengan orbital s menghasilkan hibrida mendekati bidang xy, mencampur orbital dekat-x dengan orbital s menghasilkan hibrida yang mendekati arah sumbu x.
- Untuk hibrida yang setara, orientasinya diruang ditentukan oleh (a) banyaknya orbital yang dicampur, karna itu sesuai pula dengan banyaknya hibrida yang diperoleh, (b) arah x, y, dan z hanya terjadi jika orbital ‘murni’ (tidak dicampur),(c) anggapan bahwa jika elektron menempati hibrida, elektron akan berusaha saling menjauhi dengan batas b. Misalnya, kita ingin membentuk tiga hibrida setara dengan mencampur orbital 2s,2px dan 2py pada sebuah atom. Buti b mensyaratkan bahwa arah utama terletak pada bidang xy; butir c mensyaratkan bahwa sudut 360⁰ pada bidang xy dibagi menjadi tiga bagian, sehingga sudut di antara hibrida adalah 120⁰.
- Jenis hibrida pada strukrur tertentu ditentukan melalui penelitian geometrti molekul (tetapi jika belum ada penelitian, kita masih dapat menduga bentuknya melalui pembandingan dengan molekul yang serupa). Sudut ikatan 120⁰ menyiratkan hibrida sp2, sistem linear menyiratkan hibrida sp3 dan bentuk tetrahedral atau sudut ikatan 109⁰ menyiratkan hibrida sp3.
I. ATOM KARBON

a. Hibridisasi sp3
Atom karbon memiliki dua orbital (2s dan 2p) untuk membentuk ikatan, artinya jika bereaksi dengan hidrogen maka akan terbentuk dua ikatan C-H. Faktanya, atom karbon membentuk empat ikatan C-H dan menghasilkan molekul metana dengan bentuk bangun ruang tetrahedron. Linus Pauling (1931) menjelaskan secara matematis bagaimana orbital s dan tiga orbital p berkombinasi atau terhibridisasi membentuk empat orbital atom yang ekuivalen dengan bentuk tetrahedral. Orbital yang berbentuk tetrahedral disebut dengan hibridisasi sp3. Angka tiga menyatakan berapa banyak tipe orbital atom yang berkombinasi, bukan menyatakan jumlah elektron yang mengisi orbital.
Atom karbon memiliki konfigurasi ground-state 1s2 2s2 2px1 2py1. pada kulit terluar terdapat dua elektron dalam orbital 2s, dan dua elektron tak perpasangan dalam orbital 2p:
Pada posisi tereksitasi, karbon memiliki empat elektron tak berpasangan dan dapat membentuk empat ikatan dengan hidrogen.
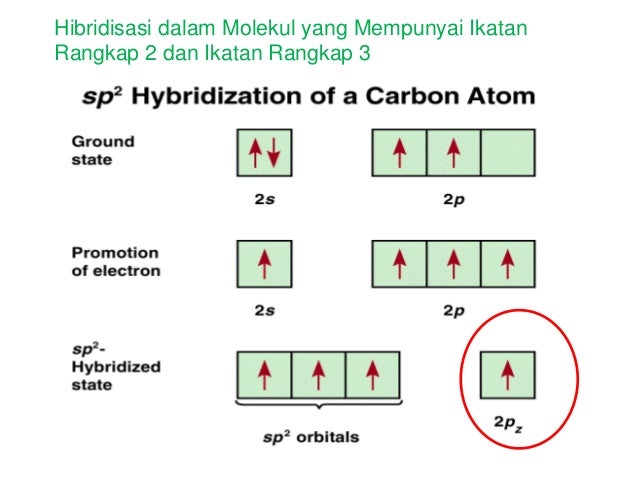
b. Hibridisasi sp2
Hibridisasi sp2 terjadi jika satu elektron tereksitasi ke orbital p. Akibatnya, atom karbon yang terhibridisasi sp2 hanya dapat membentuk tiga ikatan sigma dan satu ikatan pi. Ikatan pi terjadi sebagai akibat dari tumpang tindih elektron pada orbital 2p-2p.
Dua atom karbon sp2 dapat saling membentuk ikatan yang kuat, mereka membentuk ikatan sigma melalui overlap orbital sp2-sp2. Kombinasi ikatan sigma sp2-sp2 dan ikatan pi 2p-2p menghasilkan bentuk ikatan rangkap karbon-karbon. Bentuk bangun ruang dari ikatan atom karbon yang terhibridisasi sp2 adalah trigonal planar.
c. Hibridisasi sp
Atom karbon memiliki kemampuan membentuk tiga macam ikatan, yaitu ikatan tunggal, rangkap dua dan rangkap tiga. Di samping dapat berkombinasi dengan dua atau tiga orbital p, hibrida orbital 2s juga dapat berkombinasi dengan satu orbital p.
Orbital sp memiliki bangun ruang linear dengan sudut ikatan HC- C sebesar 1800 yang telah terverifikasi dari hasil eksperimental. Panjang ikatan hidrogen-karbon sebesar 1.06A dan panjang ikatan karbon-karbon adalah 1.20 A.
II. ATOM NITROGEN
Nitrogen mempunyai konfigurasi elektron keadaan dasar dari N adalah [He] 2s22p3. tiga dari lima elektron valensi yang digunakan untuk membentuk tiga Ikatan tunggal N―H, meninggalkan satu pasangan elektron bebas.
Struktur piramidal trigonal, berasal dari tetrahedral susunan pasangan elektron . N atom memiliki empat valensi orbital atom: 2s, 2px, 2py dan 2pz. Skema sp3 hibridisasi memberikan tetrahedral pengaturan orbital hibrida, sesuai untuk menampung empat pasang elektron. Pada atom nitrogen, oksigen dan klor dalam struktur organik juga dapat membentuk hibridisasi sp3. Nitrogen memiliki lima elektron valensi di lapisan kedua. Setelah hibridisasi, akan memiliki tiga setengah penuh orbital sp3 dan dapat membentuk tiga ikatan.
Struktur piramidal trigonal, berasal dari tetrahedral susunan pasangan elektron . N atom memiliki empat valensi orbital atom: 2s, 2px, 2py dan 2pz. Skema sp3 hibridisasi memberikan tetrahedral pengaturan orbital hibrida, sesuai untuk menampung empat pasang elektron. Pada atom nitrogen, oksigen dan klor dalam struktur organik juga dapat membentuk hibridisasi sp3. Nitrogen memiliki lima elektron valensi di lapisan kedua. Setelah hibridisasi, akan memiliki tiga setengah penuh orbital sp3 dan dapat membentuk tiga ikatan.
a. Hibridisasi sp3
Ikatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atrom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Atom nitrogmemiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masingmasing satu elektron.
Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2.
b. Hibridisasi sp2
Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena.
c. Hibridisasi sp
Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
III. ATOM OKSIGEN
a. Hibridisasi sp3
Elektron pada ground-state atom oksigen memiliki konfigurasi: 1s2 2s2 2px2 2py1 2pz1, dan oksigen merupakan atom divalen. Dengan melihat konfigurasi elektronnya, dapat diprediksi bahwa oksigen mampu membentuk dua ikatan sigma karena pada kulit terluarnya terdapat dua elektron tak berpasangan (2py dan 2pz).
b. Hibridisasi sp2
Oksigen juga dapat terhibridisasi sp2, yaitu dengan mempromosikan satu elektronnya ke orbital p. Dalam kondisi ini, oksigen hanya memiliki satu ikatan sigma, tetapi juga memilki satu ikatan pi. Contoh molekul yang memiliki atom oksigen terhibridisasi sp2 adalah pada senyawa-senyawa karbonil.
Berikut contoh hibridisasi O dalam H2O:
Molekul 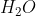 memiliki orbital
memiliki orbital 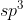
Konfigurasi elektron
H (nomor atom 1) =
O (nomor atom 8) =
Atom pusat = O
Kedaan dasar
Karena sudah tersedia 2 orbital yang berisi elektron tidak berpasangan, maka atom O dalam molekul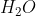 tidak mengalami eksitasi elektron, tetapi langsng pada proses hibridisasi.
tidak mengalami eksitasi elektron, tetapi langsng pada proses hibridisasi.
Orbital hibrida =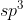
Bentuk molekul = sudut (karena punya dua pasangan elektron bebas)
Terdapat dua pasang elektron ikatan yang digunakan bersama dengan atom H.
Kepolaran = Polar (karena bentuk molekul yang asimetri)
Konfigurasi elektron
H (nomor atom 1) =
O (nomor atom 8) =
Atom pusat = O
Kedaan dasar
Karena sudah tersedia 2 orbital yang berisi elektron tidak berpasangan, maka atom O dalam molekul
Orbital hibrida =
Bentuk molekul = sudut (karena punya dua pasangan elektron bebas)
Terdapat dua pasang elektron ikatan yang digunakan bersama dengan atom H.
Kepolaran = Polar (karena bentuk molekul yang asimetri)
Permasalahan : Apa yang menyebabkan
suatu atom mengalami hibridisasi sp3, sp2, dan sp?
DAFTAR PUSTAKA
https://amaliaazizah4.wordpress.com/2013/05/22/hibridisasi-i-sejarah-penemuan-hibridisasiteori-hibridisasi-dipromosikan-oleh-kimiawan/
http://sriwahyuningsihd.blogspot.co.id/2016/09/hibridisasi-atom-karbon-nitrogen-dan_12.html
https://dokumen.tips/documents/makala-hibridisasi.html
https://ulthawindaraekawardanni.wordpress.com/2016/09/12/hibridisasi-orbital-dan-ikatan-rangkap-terkonjugasi/
http://www.chemistricks.com/2017/01/teori-hibridasi-dan-contoh-soal.html
http://lukitasari15002.blogspot.co.id/2016/09/tugas-kimia-organik.html




Bisakah anda tunjukkan dari contoh hibridisasi diatas yang mana ikatan v dan sigma?
BalasHapusContoh hibridisasi diatas hanya menunjukkan bentuk dari ikatan phi. Hal ini dikarenakan ikatan phi adalah ikatan kimia Kovalen yang dua cuping orbital atom yang berelektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya yang juga berelektron tunggal. Sedangkan ikatan sigma adalah ikatan Kovalen yang terbentuk akibat tumpang tindih orbital-orbital ujung ke ujung, dengan kerapatan elektron yang terkonsentrasi diantara inti atom yang berikatan.
HapusBagaimana pembentukan orbital hybrid melalui proses hibridisasi
BalasHapusPembentukan orbital hybrid melalui proses hibridisasi adalah sebagai berikut :
HapusSalah satu electron yang berpasangan berpromosi ke orbital yang lebih tinggi tingkat energinya sehingga jumlah electron yang tidak berpasangan sama dengan jumlah ikatan yang akan terbentuk. Atom yang sedemikian disebut dalam keadaan tereksitasi. Promosi yang mungkin adalah dari ns ke np dan ns ke ns ke nd atau (n-1)d
Penggabungan orbital mengakibatkan kerapatan electron lebih besar di daera orbital hybrid.
Terjadi tumpang tindih orbital hybrid dengan orbital atom lain sehingga membentuk ikatan kovalen atau kovalen koordinasi.
Menurut saya blog saudara sudah cukup bagus,hanya saja saya masih kurang mengerti mengenai steuktur gambar hibridisasi sp dari niteogen.
BalasHapus1. Atom Nitrogen
HapusIkatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atrom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Amonia, NH3, salah satu contoh molekul yang mengandung ikatan kovalen yang melibatkan atom nitrogen. Atom nitrogen memiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen.
Ketika terdapat tiga elektron tak berpasangan mengisi orbital 2p, ini memungkinkan orbital 1s dari hidrogen untuk overlap dengan orbital 2p tersebut membentuk ikatan sigma. Sudut ikatan yang terbentuk adalah 107.30, mendekati sudut tetrahedral (109.50). Nitrogen memiliki lima elektron pada kulit terluarnya. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing masing satu elektron.
Ikatan sigma terbentuk dari overlap orbital hibrida sp3 yang tidak berpasangan tersebut dengan orbital 1s dari hydrogen menghasilkan molekul ammonia. Dengan demikian, ammonia memiliki bentuk geometri tetrahedral yang mirip dengan metana. Ikatan N-H memiliki panjang 1.01 A dan kekuatan ikatan 103 kkal/mol.
Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena. Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
1. Atom Nitrogen
HapusIkatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atrom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Amonia, NH3, salah satu contoh molekul yang mengandung ikatan kovalen yang melibatkan atom nitrogen. Atom nitrogen memiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen.
Ketika terdapat tiga elektron tak berpasangan mengisi orbital 2p, ini memungkinkan orbital 1s dari hidrogen untuk overlap dengan orbital 2p tersebut membentuk ikatan sigma. Sudut ikatan yang terbentuk adalah 107.30, mendekati sudut tetrahedral (109.50). Nitrogen memiliki lima elektron pada kulit terluarnya. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing masing satu elektron.
Ikatan sigma terbentuk dari overlap orbital hibrida sp3 yang tidak berpasangan tersebut dengan orbital 1s dari hydrogen menghasilkan molekul ammonia. Dengan demikian, ammonia memiliki bentuk geometri tetrahedral yang mirip dengan metana. Ikatan N-H memiliki panjang 1.01 A dan kekuatan ikatan 103 kkal/mol.
Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena. Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
Kenapa bisa terjadi hibridisasi sp, sp², dan sp³?
BalasHapusBila dicontohkan pada nitrogen,
Hapusa. Hibridisasi sp3
Ikatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Atom nitrogen memiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing-masing satu elektron.
b. Hibridisasi sp2
Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena.
c. Hibridisasi sp
Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
Bila dicontohkan pada nitrogen,
Hapusa. Hibridisasi sp3
Ikatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Atom nitrogen memiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing-masing satu elektron.
b. Hibridisasi sp2
Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena.
c. Hibridisasi sp
Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
saya ingin menambahkan tentang hibridisasi nitrogen
BalasHapuselektronegatifitas nitrogen jauh lebih tinggi dibanding dengan anggota-anggota lainnya dalam golongannya. Akibatnya, sifat polaritas ikatan dalam senyawa nitrogen sering berlawanan dengan sifat polaritas ikatan dalam senyawa anggota lainnya.
Terima kasih atas penambahan materinya. Sangat bermanfaat.
Hapus