STEREOKIMIA
STEREOKIMIA
Stereokimia : studi mengenai molekul-molekul dalam ruang tiga dimensi, yakni
bagaimana atom-atom dalam sebuah molekul ditata dalam ruangan satu relatif
terhadap yang lain.
Stereoisomer : senyawa berlainan yang mempunyai struktur sama, berbeda hanya
dalam hal penataan atom-atom dalam ruangan.
isomer adalah molekul-molekul dengan rumus kimia yang sama (dan sering dengan jenis ikatan yang sama), namun memiliki susunan atom yang berbeda.
A. Isomer Geometri dalam Alkena dan Senyawa Siklik
isomer ialah molekul-molekul dengan rumus kimia yang sama (dan sering
dengan jenis ikatan yang sama), namun memiliki susunan atom yang berbeda.
Kebanyakan isomer memiliki sifat kimia yang mirip satu sama lain. dimana dalam
suatu proses pemahaman tentang struktu-struktur molekul masih cukup sulit untuk
dimengerti. Untuk itu dalam makala kali ini akan membahas mengenai isomer, yang
lebih spesifiknya akan membahas sub bab tentang isomer geometri yaitu bagaimana
cara memberi nama pada suatu struktur molekul dalam alkena dan aturan apa saja
yang dipakai dalam proses penamaannya.
isomer ialah molekul-molekul dengan rumus kimia yang sama (dan sering
dengan jenis ikatan yang sama), namun memiliki susunan atom yang berbeda.
Kebanyakan isomer memiliki sifat kimia yang mirip satu sama lain. dimana dalam
suatu proses pemahaman tentang struktu-struktur molekul masih cukup sulit untuk
dimengerti. Untuk itu dalam makala kali ini akan membahas mengenai isomer, yang
lebih spesifiknya akan membahas sub bab tentang isomer geometri yaitu bagaimana
cara memberi nama pada suatu struktur molekul dalam alkena dan aturan apa saja
yang dipakai dalam proses penamaannya.isomer ialah molekul-molekul dengan rumus kimia yang sama (dan sering
dengan jenis ikatan yang sama), namun memiliki susunan atom yang berbeda.
Kebanyakan isomer memiliki sifat kimia yang mirip satu sama lain. dimana dalam
suatu proses pemahaman tentang struktu-struktur molekul masih cukup sulit untuk
dimengerti. Untuk itu dalam makala kali ini akan membahas mengenai isomer, yang
lebih spesifiknya akan membahas sub bab tentang isomer geometri yaitu bagaimana
cara memberi nama pada suatu struktur molekul dalam alkena dan aturan apa saja
yang dipakai dalam proses penamaannya.isomer ialah molekul-molekul dengan rumus kimia yang sama (dan sering
dengan jenis ikatan yang sama), namun memiliki susunan atom yang berbeda.
Kebanyakan isomer memiliki sifat kimia yang mirip satu sama lain. dimana dalam
suatu proses pemahaman tentang struktu-struktur molekul masih cukup sulit untuk
dimengerti. Untuk itu dalam makala kali ini akan membahas mengenai isomer, yang
lebih spesifiknya akan membahas sub bab tentang isomer geometri yaitu bagaimana
cara memberi nama pada suatu struktur molekul dalam alkena dan aturan apa saja
yang dipakai dalam proses penamaannya.
Isomer geometrik atau isomer cis-trans : stereoisomer yang berbeda karena
gugus-gugus berada pada satu sisi atau pada sisi-sisi yang berlawanan terhadap
letak ketegaran molekul. Isomerisme cis-trans atau isomerisme geometrik atau isomerisme konfigurasi adalah sebuah bentuk stereoisomerisme yang menjelaskan orientasi gugus-gugus fungsi dalam sebuah molekul. Secara umum, isomer seperti ini mempunyai ikatan rangkap yang tidak dapat berputar. Selain itu, isomer ini juga muncul dikarenakan struktur cincin molekul yang menyebabkan perputaran ikatan sangat terbatas.
Terdapat dua bentuk isomer cis-trans, yaitu cis dan trans. Ketika gugus substituen berorientasi pada arah yang sama, diastereomer ini disebut sebagai cis. Sedangkan ketika gugus substituen berorientasi pada arah yang berlawanan, diastereomer ini disebut sebagai trans. Contoh molekul hidrokarbon yang menunjukkan isomerisme cis-trans adalah 2-butena.
a. Isomer Geometri dalam Alkena
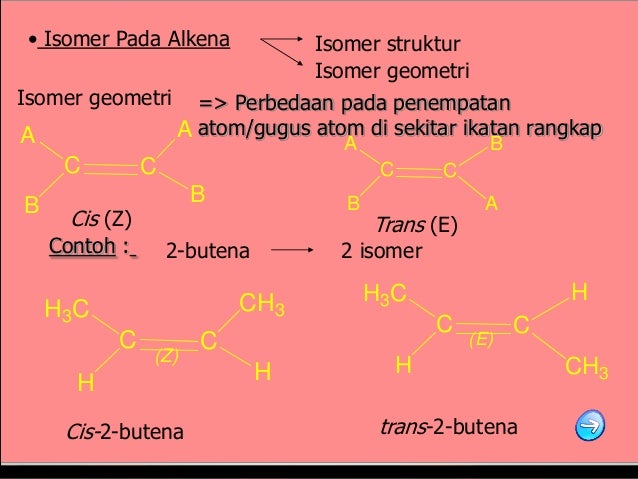

Persyaratan isomer geometri dalam alkena ialah bahwa tiap atom karbon yang terlibat dalam ikatan pi mengikat dua gugus yang berlainan, misalnya H dan Cl, CH3 dan Cl. Jika satu atom karbon berikatan rangkap itu mempunyai dua gugus identik, misal dua atom H atau dua gugus CH3, maka tak mungkin terjadi isomer geometri. Berikut contoh isomer geometri:

Dalam contoh ini Br dan Cl dapat dikatakan trans atau bentuk cis pada I dan Cl. Tetapi struktur itu dalam keseluruhannya tak dapat dinamai sebagai cis atau trans. Maka dikembangkan sistem penamaan isomer yang lebih umum yaitu sistem (E) dan(Z). Sistem (E) dan (Z) ini didasarkan pada suatu pemberian prioritas ( jangan dikelirukan dengan prioritas tata nama) kepada atom atau gugus yang terikat pada masing-masing ataom karbon ikatan rangkap. Jika atom atau gugus yang berprioritas tinggi berada pada sisi yang berlawanam (dari) ikatan pi, maka isomer itu adalah (E). Jika gugus gugus priorotas tinggi itu berada dalam satu sisi, maka isomer itu (Z). Huruf (E) berasal dari bahasa Jerman yaitu entgegen artinya berseberagan sedangkan (Z) yaitu Zusammen artinya bersama-sama. Sistem (E) dan (Z) didasarkan pada skala prioritas kepada atom atau gugus yang terikat pada masing-masing atom karbon ikatan rangkap. Atom dengan bobot atom yang lebih tinggi memperoleh prioritas yang lebih tinggi. Atom Iod memiliki bobot yang lebih tinggi dari atom Brom, sehingga atom Iod berprioritas tinggi, dan atom Chlor lebih diprioritaskan daripada Fluor.
Tata nama (E) dan (Z)
Bila tiga atau empat gugus yang terikat pada atom-atom karbon dalam suatu ikatan rangkap berlainan, maka pemberian tatanama isomer cis-trans kadang-kadang sulit, contohnya pada senyawa dibawah ini.
Br F
\ /
C = C
/ \
I Cl
Cis atau trans?
b. Isomer Geometri dalam Senyawa Siklik
Pada beberapa hal, sifat kimia sikloalkana mirip dengan alkana asikloik (rantai terbuka). Keduanya sama-sama non polar dan cenderung inert. Akan tetapi terdapat perbedaan mendasar. Pertama, sikloalkana kurang fleksibel dibandingkan dengan alkana rantai terbuka. Ikatan tunggal (ikatan sigma) pada alkana asliklik dapat berputar.
Pada sikloalkana, ikatan yang terbentuk kurang bebas untuk berputar. Misalnya siklopentana, bentuknya adalah segitiga rigid dan planar. Putaran pada ikatan karbon-karbon tidak mungkin terjadi tanpa merusak cincin.
Oleh karena strukturnya yang siklik, sikloalkana memiliki dua sisi yaitu sisi atas dan bawah. Hal ini memungkinakn sikloheksana memiliki kemungkinan isomerisme berdasarkan letak substituennya. Contohnya, ada dua bentuk isomer dari 1,2-dimetilsiklopropana. Pertama dengan dua gugus metil pada sisi yang sama, kedua dengan gugus metil pada posisi yang berlawanan. Kedua bentuk isomer merupakan molekul yang stabil, dan dapat dikonfersi dari bentuk satu ke bentuk lainnya tanpa memecah cincin atau tanpa membentuk ikatan baru.
Tidak seperti isomer konstitusional seperti pada butana dan isobutana dimana terdapat perbedaan urutan penempatan atom- atomnya. Kedua isomer 1,2dimetilsiklopropana memiliki tempat ikatan yang sama, tetapi berbeda pada posisi atom-atomnya. Semua senyawa yang memiliki posisi ikatan atom yang sama tetapi berbeda pada orientasi tiga dimensinya disebut stereoisomer.
B. Konformasi dan Kiralitas Senyawa Rantai Terbuka
a. Konformasi Senyawa Rantai Terbuka
Konformasi Molekul : bentuk molekul dan bagaimana bentuk ini dapat berubah. Dalam senyawa rantai terbuka, gugus-gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan itu. Oleh karena itu atom-atom dalam suatu molekul rantai terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu terhadap yang lain. Memang etana merupakan sebuah molekul kecil, tetapi etana dapat memiliki penataan dalam ruang secara berlain-lainan, inilah yang disebut konformasi.
Konformasi Senyawa Rantai Terbuka (Alifatik)
Dalam senyawa rantai terbuka gugus gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan tersebut. Oleh karena itu atom – atom dalam suatu molekul – molekul terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu terhadap yang lain. Memang etana sebuah molekul kecil, tetapi etana dapat memiliki penataan dalam ruang secara berlain – lainan, penataan tersebut disebut konformasi. Untuk mengemukakan konformasi digunakan tiga jenis rumus : rumus dimensional, rumus bola dan pasak dan proyeksi Newman. Suatu rumus bola dan pasak dan rumus dimensional adalah representasi 3-dimensi dari model molekul suatu senyawa. Suatu proyeksi Newman adalah pandangan ujung ke ujung dari dua atom karbon saja dalam molekul itu. Ikatan yang menghubungkan kedua atom karbon ini tersembunyi . ketiga ikatan dari karbon depan tampak menuju ke pusat proyeksi, dan ketiga ikatan dari karbon belakang hanya tampak sebagian.
Proyeksi Newman dapat digambar untuk molekul dengan dua atom karbon atau lebih. Karena pada tiap kali hanya dua atom karbon dapat ditunjukan dalam proyeksi itu, maka lebih dari satu proyeksi Newman dapat digambar untuk sebuah molekul. Suatu molekul dapat memiliki beberapa konformasi atau konformasi yang berbeda-beda karena disebabkan adanya rotasi mengelilingi ikatan sigma. Konformasi yang berbeda-beda itu disebut konformer (dari kata “conformational isomers”). Misalnya, konformasi goyang,dimana atom-atom hidrogen atau gugus-gugus terpisah sejauh mungkin satu dari yang lain. Karena ikatan C–C dapat berotasi, maka atom-atom hidrogen dapat juga saling menutup atau sedapat mungkin berdekatan satu di belakang yang lain yang disebut dengan konformasi eklips.Rotasi mengelilingi ikatan sigma seringkali disebut rotasi bebas, tetapi sebenarnya rotasi ini tidaklah benar-benar bebas. Konformasi eklips (dari) etana kira-kira 3 kkal/mol kurang stabil
(lebih tinggi energinya) dibandingkan dengan konformer goyang, karena adanya tolak-menolak antara elektron-elektron ikatan dan atom-atom hidrogen. Untuk berotasi dari konformasi goyang ke konformasi eklips satu mol molekul etana memerlukan 3 kkal energi. Karena pada temperatur kamar jumlah energi ini mudah diperoleh, maka rotasi itu dapat berlangsung dengan mudah, inilah sebabnya konformasi yang berbeda-beda bukanlah isomer. Tetapi, meskipun konformasi-konformasi etana mudah dipertukarkan pada temperatur kamar,
pada saat kapan saja sebagian besar molekul etana berada dlam konformai goyang karena energinya lebih rendah.
Gambar 4.3 Pasang surutnya energi potensial oleh rotasi mengelilingi ikatan C-C dalam etana., seperti etana dapat memiliki konformasi eklips dan goyang. Dalam butana terdapat dua gugus metil yang relatif besar, terikat pada dua karbon pusat. Dipandang dari ke dua karbon pusat, hadirnya gugus-gugus metil ini menyebabkan terjadinya dua macam konformasi goyang, yang berbeda dalam hal posisi gugus-gugus metil ini satu terhadap yang lain.Butana (CH3CCH2CH3), seperti etana, dapat memiliki konformasi eklips dan goyang.
Dalam butana terdapat dua gugus metil yang relatif besar , terikat pada dua karbon pusat. Dipandang dari kedua karbon pusat, hadirnya gugus-gugus metil ini menyebabkan terjadinya
dua macam konformasi goyang, yang berbeda dalam hal posisi gugus-gugus metil ini satu terhadap yang lain. Konformasi goyang dalam mana gugus-gugus metil terpisah sejauh mungkin disebut conformer anti (Yunani: anti, “melawan”). Konformasi goyang ini di mana gugus-gugus lebih berdekatan, disebut conformer gauche (Perancis: gauche, “kiri” atau
“terkelit”). Di bawah ini proyeksi Newman untuk rotasi setengah penuh. Rotasi sebagian mengelilingi ikatan karbon 2-karbon 3 dari butana (karbon belakang yang berputar):
Makin besar gugus-gugus yang terikat pada kedua atom karbon, akan makin besar selisih energy antara konformasi-konformasi molekul itu. Diperlukan lebih banyak energy untuk mendorong dua gugus besar agar berdekatan daripada gugus kecil. Etana membutuhkan hanya 3 kkal/mol untuk berotasi dari konformasi goyang ke eklips, sedangkan butana memerlukan 4,5 kkal/mol untuk berotasi dari konformasi anti ke konformasi dimana gugusgugus metil eklips. Hubungan energy untuk rotasi penuh mengelilingi ikatan karbon 2-karbon 3 butana ditunjukkan dalam Gambar dibawah
Konformasi adalah penataan suatu senyawa dalam ruang secara berlainan, di dalam senyawa rantai terbuka terdapat konformasi dasar untuk mempermudah penggambaran senyawa dalam ruang yaitu rumus dimensional, rumus bola dan pasak, dan rumus proyeksi Newman. Dan di dalam konformasi yang berbeda beda disebut konformer. Dalam rumus – rumus etana dimana atom-atom hydrogen atau gugus – gugus terpisah sejauh mungkin antara satu dengan yang lain disebut konformasi goyang. Dan juga terdapat konformasi anti dan konformasi
b. Kiralitas senyawa rantai terbuka
Kiralitas (chirality) :bagaimana penataan kiri atau kanan atom- atom disekitar sebuah atom karbon dapat mengakibatkan isomeri.

Permasalahan : Apa yang menyebabkan isomer cis dan trans tidak dapat berputar? Apakah cis dan trans dapat terjadi pada semua senyawa?
DAFTAR PUSTAKA
http://staff.uny.ac.id/sites/default/files/Stereokimia-010.pdf
https://dokumen.tips/documents/tugas-stereo-kimia-55c99d7ca05f3.html
http://soniafriansyah1997.blogspot.co.id/2016/09/resume-pertemuan-keenam-stereokimia-1.html
http://mirandaoxtariani.blogspot.co.id/2016/10/resume-kimia-organik-1pertemuan-ke-6.html
http://frandimardiansyah.blogspot.co.id/2016_10_02_archive.html








mengapa atom yang menghasilkan isomer berada pada posisi yang sama namun memiliki pengaturan keruangan yang berbeda dalam stereoisomer?
BalasHapusMinggu lalu kita telah mempelajari isomer struktural, dimana isomer struktural adalah rumus molekul sama tetapi struktur dan sifat (fisika dan kimia) berbeda. Nah umateri isomer struktural ini berkaitan dengan stereokimia, dimana kita bisa membedakannya dengan cara mengibaratkannya. Misalnya diibaratkan kita belajar di kelas tiap hari selasa posisi kita duduk yang berbeda-beda tiap minggunya bisa dikatakan itu isomer struktural dan dengan posisi kita duduk sama tetapi arahnya berbeda seperti kita menghadap ke samping bisa dikatakan sebagai stereokimia.
HapusPersyaratan isomer geometri dalam alkena ialah bahwa tiap atom karbon yang terlibat dalam ikatan pi mengikat dua gugus yang berlainan, misalnya H dan Cl, CH3 dan Cl. Jika satu atom karbon berikatan rangkap itu mempunyai dua gugus identik, misal dua atom H atau dua gugus CH3, maka tak mungkin terjadi isomer geometri.
Assalammualaikum marta saya ingin menambahkan sedikit mengenai sifat fisik cis dan trans yaitu sebagai berikut :
BalasHapusIsomer cis dan isomer trans sering kali memiliki sifat-sift fisika yang berbeda. Perbedaan antara isomer pada umumnya disebabkan oleh perbedaan bentuk molekul atau momen dipol secara keseluruhan.
Perbedaan ini dapatlah sangat kecil, seperti yang terlihat pada titik didih alkena berantai lurus 2-pentena (titik didih isomer trans 36 °C dan isomer cis 37 °C)[1]. Perbedaan isomer cis dan trans juga dapat sangat besar, seperti pada kasus siklooktena. Isomer cis senyawa ini memiliki titik didih 145 °C[2], sedangkan isomer transnya 75 °C.[3] Perbedaan yang sangat besar antara kedua isomer siklooktena disebabkan oleh terikan cincin yang besar untuk trans-siklooktena, yang juga menyebabkannya kurang stabil dibandingkan isomer cis. Bahkan, kedua isomer asam 2-butenadioat memiliki sifat-sifat dan reaktivitas yang sangat berbeda sehingga mempunyai nama yang berbeda pula. Isomer cisnya disebuah asam maleat, sedangkan isomer transnya disebuat asam fumarat
Dapat dipersingkat bahwa polaritas merupakan faktor kunci yang menentukan titik didih relatif senyawa karena ia akan meningkatkan gaya antar molekul, sedangkan simetri merupakan faktor kunci yang menentukan titik leleh relatif karena ia mengizinkan penataan molekul yang lebih baik pada bentuk padat. Oleh karena itu, trans-alkena yang kurang polar dan lebih simetris cenderung memiliki titik didih yang lebih rendah dan titik leleh yang lebih tinggi. Sebaliknya cis-alkena secara umum memiliki titik didih yang lebih tinggi dan titik leleh yang lebih rendah.
Terima kasih atas tambahannya.
HapusBagaimana bentuk senyawa kristalitas??
BalasHapusSenyawa Kiral adalah ketika empat ligan yang berbeda terikat kepada karbon tetravalent, menghasilkan molekul asimetris yang mana atom karbon sebagai pusat asimetrisnya.
HapusApakah 2-butena mempunyai isomer geometri ?
BalasHapus2-butena yang memiliki berikut ini
HapusH 3 C – CH = CH – CH 3 mempunyai 2 isomer geometri, yaitu cis 2-butena dan trans 2-butena
hai marta. postingan yg bagus dan sangat bermanfaat. setelah membacanya, Bisakah anda berikan contoh lain dari pembuatan cis dan trans yang lebih mudah dipahami dengan menggunakan aturan Sistem Tata Nama (E) dan (Z)?
BalasHapusSistem (E) dan (Z) ini didasarkan pada suatu pemberian prioritas ( jangan dikelirukan dengan prioritas tata nama) kepada atom atau gugus yang terikat pada masing-masing ataom karbon ikatan rangkap. Jika atom atau gugus yang berprioritas tinggi berada pada sisi yang berlawanam (dari) ikatan pi, maka isomer itu adalah (E). Jika gugus gugus priorotas tinggi itu berada dalam satu sisi, maka isomer itu (Z). Cara penandaan E dan Z Aturan yang digunakan untuk memberikan urutan prioritas disebut aturan Cahn-Ingold-Prelog (diambil dari nama ilmuwan yang menemukannya). Aturan-aturan tersebut adalah sebagai berikut: Aturan 1 : Lihat pada atom yang terikat langsung pada karbon ikatan rangkap lalu urutkan substituen tersebut berdasarkan nomor atomnya. Cl CH3H3C H CH3 ClH3C H tinggi rendah rendah rendahrendah tinggi tinggi tinggi Br Cl O N C H> > > > > 16781735 (E)-2-kloro-2-butena (Z)-2-kloro-2-butena. Klorin memiliki nomor atom lebih besar dibandingkan karbon, sehingga substituen Cl menerima prioritas lebih tinggi dibandingkan metil. Aturan 2 : Jika pengurutan prioritas tidak dapat dilakukan menggunakan atom pertama yang terikat langsung pada karbon ikatan rangkap maka gunakan prioritas atom berikutnya. Substituen -CH2CH3 dan –CH3 memiliki prioritas yang sama jika digunakan aturan 1 karena kedua atom yang terikat langsung pada karbon ikatan rangkap adalah atom karbon juga. Dengan aturan 2, gugus etil menerima prioritas lebih tinggi dari pada metil karena etil memiliki prioritas lebih tinggi pada atom kedua. Atom karbon yang terikat pada karbon ikatan rangkap, masih mengikat satu karbon lain, sedangkan atom kedua pada gugus metil adalah hidrogen. Aturan 3 : Ikatan rangkap diangkap sama dengan sebagai ikatan tunggal tetapi dengan jumlah sesuai dengan ikatan rangkapnya. Contohnya, substituen aldehid (-CH=O), memiliki ikatan rangkap antara karbon dengan oksigen, hal ini dianggap sama dengan satu karbon mengikat dua buah oksigen.
BalasHapus