Orbital dan Peranannya dalam Ikatan Kovalen
ORBITAL DAN PERANANNYA DALAM IKATAN KOVALEN
A. Orbital Hibrida dari Nitrogen dan Oksigen
Orbital adalah ruang dimana ditemukannya elektron dalam suatu wilayah yang cukup dekat dengan inti atom. Dengan kata lain, orbital sebagai wilayah ruang dimana kehidupan elektron terjadi. Orbital hibrida adalah hibridisasi atau penggabungan orbital dalam suatu atom menjadi setara, kemudian tumpang tindih dengan orbital dari atom lain membentuk orbital molekul.
Teori orbital molekul mengkombinasikan kecenderungan atom
untuk mencapai keadaan oktet dengan sifat-sifat geombangnya,
menempatkan elektron-elektron pada suatu tempat yang disebut
orbital. Menurut teori orbital molekul, ikatan kovalen dibentuk dari
kombinasi orbital-orbital atom membentuk orbital molekuler; yaitu
orbital yang dimiliki oleh molekul secara keseluruhan. Seperti orbital
atom, yang menjelaskan volume ruang di sekeliling inti atom di mana
elektron mungkin ditemukan, orbital molekuler menjelaskan volume
ruang di sekeliling molekul di mana elektron mungkin ditemukan.
Orbital molekuler juga memiliki bentuk ukuran dan energi yang
spesifik.
Mari kita lihat pada contoh pertama kita dalam molekul
hidrogen (H2). Orbital 1s dari satu atom hidrogen mendekati orbital 1s
dari atom hidrogen kedua, kemudian keduanya melakukan overlap
orbital. Ikatan kovalen terbentuk ketika dua orbital s mengalami
overlap, disebut dengan ikatan sigma (σ). Ikatan sigma berbentuk
silindris simetris , elektron dalam ikatan ini terdistribusi secara
simetris/ berada di tengah antara dua atom yang berikatan.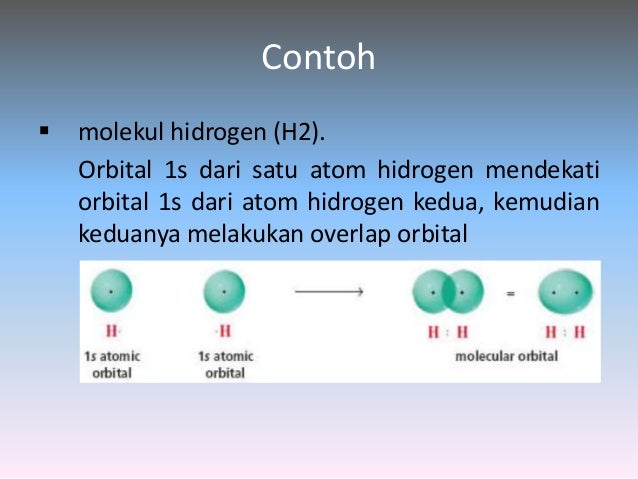
1) Atom Nitrogen
Ikatan kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atrom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama dengan pada atom karbon.
Amonia, NH3, salah satu contoh molekul yang mengandung ikatan kovalen yang melibatkan atom nitrogen. Atom nitrogen memiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen.

Ketika terdapat tiga elektron tak berpasangan mengisi orbital 2p, ini memungkinkan orbital 1s dari hidrogen untuk overlap dengan orbital 2p tersebut membentuk ikatan sigma. Sudut ikatan yang terbentuk adalah 107.3 derajat, mendekati sudut tetrahedral (109.5 derajat). Nitrogen memiliki lima elektron pada kulit terluarnya. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing-masing satu elektron.

Gambar : Konfigurasi elektron atom nitrogen sp3
Ikatan sigma terbentuk dari overlap orbital hibrida sp3 yang
tidak berpasangan tersebut dengan orbital 1s dari hidrogen
menghasilkan molekul ammonia. Dengan demikian, ammonia
memiliki bentuk geometri tetrahedral yang mirip dengan metana.
Ikatan N-H memiliki panjang 1.01 A dan kekuatan ikatan 103
kkal/mol.
Nitrogen memiliki tiga elektron tak berpasangan pada orbital
hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut
tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron
pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom
nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang
digunakan untuk membentuk ikatan rangkap dua, mirip dengan
molekul etena. Apabila elektron yang tereksitasi ke orbital p ada dua
maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau
satu ikatan rangkap tiga (hibridisasi sp).
Gambar : Konfigurasi elektron atom nitrogen sp2 dan sp

2) Atom Oksigen
Elektron pada ground-state atom oksigen memiliki konfigurasi:
1s2 2s2 2px
2 2py
1 2pz
1, dan oksigen merupakan atom divalen.

Gambar: Molekul air
Dengan melihat konfigurasi elektronnya, dapat diprediksi bahwa
oksigen mampu membentuk dua ikatan sigma karena pada kulit
terluarnya terdapat dua elektron tak berpasangan (2py dan 2pz).

Air adalah contoh senyawa yang mengandung oksigen sp3. Sudut ikatan yang terbentuk sebesar 104.5 derajat. Diperkirakan bahwa orbital
dengan pasangan elektron bebas menekan sudut ikatan H-O-H,
sehingga sudut yang terbentuk lebih kecil dari sudut ideal (109.5 derajat),
seperti halnya pasangan elektron bebas dalam ammonia menekan
sudut ikatan H-N-H.
Oksigen juga dapat terhibridisasi sp2, yaitu dengan
mempromosikan satu elektronnya ke orbital p.

Dalam kondisi ini, oksigen hanya memiliki satu ikatan sigma, tetapi
juga memilki satu ikatan pi. Contoh molekul yang memiliki atom
oksigen terhibridisasi sp2 adalah pada senyawa-senyawa karbonil.

B. Ikatan rangkap terkonjugasi
Pengaturan kembali electron melalui orbital π, terutama dalam system konjugasi atau senyawa organik yang atom-atomnya secara kovalen berikatan tunggal dan ganda secara bergantian (C=C-C=C-C) dan mempengaruhi satu sama lainnya membentuk daerah delokalisasi electron disebut dengan konjugasi. Elektron-elektron pada daerah delokalisasi ini bukanlah milik salah satu atom, melainkan milik keseluruhan system konjugasi ini.
Contoh: Fenol (C6H5OH) memiliki sistem 6 elektron di atas dan di bawah cincin planarnya sekaligus di sekitas gugus hidroksil. Sistem konjugasi secara umumnya akan menyebabkan delokalisasi elektron disepanjang orbital p yang parallel satu dengan lainnya. Hal ini akan meningkatkan stabilitas dan menurunkan energi molekul secara keseluruhan. Konjugasi dapat terjadi dengan keberadaan gugus pendonor orbital p yang berbeda. Selain ikatan tunggal dan ganda yang bergantian, sisten konjugasi dapat juga terbentuk oleh keberadaan atom yang memiliki orbital p secara parallel. Contoh, furan.
Ikatan rangkap konjugasi adala ikatan rangkap selang seling dengan ikatan tunggal atau disebut juga elektronnya dapat berpindah-pindah (terdelokalisasi). Ikatan rangkap terkonjugasi ini berfungsi untuk membentuk struktur molekul yang lebih stabil. 1,3 butadiena (CH2=CH-CH=CH2) merupakan diena yang terkonjugasi. Ikatan rangkap memiliki energi yang lebih rendah, sehingga mudah diputuskan, sebaliknya ikatan tunggal memiliki energi yang tinggi sehingga susah untuk diputuskan. Konjugasi juga bisa disebut kestabilan struktur.
Isomer cis-trans terjadi bila tiap-tiap atom C yang berikatan rangkap mengikat gugus atom berbeda. Isomer geometri menghasilkan 2 bentuk isomer yaitu bentuk cis(jika gugus-gugus sejenis terletak pada sisi yang sama atau orientasinya searah) dan bentuk trans (jika gugus-gugus sejenis terletak berseberangan atau orientasinya berlawanan).
Tegangan sterik dan energi kinetik pada cis lebih besar dibandingan dengan trans, sehingga trans lebih stabil dibandingkan cis, semakin sedikit halangan sterik maka semakin stabil ikatan tersebut.Kalau ditinjau dari segi titik didih dan titih leleh, trans lebih mudah mendidih dari pada cis, sebaliknya cis lebih cepat mencair daripada trans karena cis memiliki kerapatan yang kuat, namun memiliki energi kinetik yang kuat serta kurang stabil sehingga lebih mudah untuk mencair dibandingkan dengan trans.
C. Benzena dan Resonansi
a. Benzena
1. Pengertian
Struktur benzena pertama kali diperkenalkan oleh Kekule pada tahun 1865. Menurutnya, keenam atom karbon pada benzena tersusun secara melingkar membentuk segi enam beraturan dengan sudut ikatan masing-masing 120 derajat. Ikatan antara karbon adalah ikatan rangkap dua dan ikatan tunggal yang berselang seling. Benzenamerupakan suatu senyawa hidrokarbon dengan rumus molekul C6H6, dan rumus strukturnya merupakan rantai lingkar (siklis) dengan ikatan rangkap selang seling. Kedudukan ikatan rangkap pada senyawa karbon ini dapat berpindah – pindah posisi.
Peristiwa ini disebut resonansi ikatan rangkap. Oleh karena posisi ikatan rangkap yang tidak pasti ini, akhirnya senyawa ini digambarkan sebagai cinci lingkar. Ikatan rangkap yang terdapat pada benzen disebut dengan ikatan rangkap terkonjugasi. Struktur demikian diperkenalkan pertama kali oleh Kekule. Senyawa yang mengandung cincinbenzena dikenal dengan nama senyawa aromatis. Senyawa aromatis dapat berisi satu, dua, tiga, atau lebih cincin benzena. Adanya ikatan rangkap terkonjugasi (selang – seling) pada benzen, menjadikan senyawa hidro karbon ini sebagai molekul yang relatif stabil dan bersifat khas. Kestabilan benzena ditunjukan oleh lambatnya reaksi benzen dengan halogen.
Senyawa aromatik terdiri dari kelas hidrokarbon yang mencakup enam anggota dan memiliki cincin karbon tak jenuh di mana elektron valensi ikatan pi terdelokalisasi atau terkonjugasi. Senyawa ini bersifat stabil dan melimpah baik dalam bentuk alami maupun sintetisnya. Nama aromatik diambil berdasarkan pada aroma kuat yang dihasilkannya. Struktur molekul senyawa ini berbentuk siklik dan datar. Menurut aturan Huckel setiap atom siklik harus memiliki orbital p yang tegak lurus bidang cincin.
Senyawa hidrokarbon aromatik pada umumnya bersifat non polar seperti halnya senyawa hidrokarbon alifatik dan alisiklik. Karena bersifat non polar, maka senyawa ini tidak dapat larut dalam air. Benzena sendiri merupakan molekul aromatik paling sederhana juga sering dijadikan pelarut organik. Keistimewaan benzena yaitu dapat membentuk azeotrop dengan air. Senyawa benzena dapat disubstitusi oleh gugs lain sehingga dapat mengalami isomerisasi pada strukturnya. Hal ini dikarenakan adanya perbedaan urutan penempatan substituen pada struktur cincinnya.
Isomer yang dapat dibentuk yaitu isomer orto (o-), para (p-), dan meta (m-). Isomer para akan memiliki titik leleh yang lebih tinggi dibandingkan dengan isomer lainnya, karena lebih simetris. Dengan demikian, maka isomer ini dapat membentuk kisi kristal yang sifatnya lebih teratur dan lebih kuat.
2. Sifat Fisik Benzena
Berikut ini adalah sifat fisik yang di miliki Benzena :
· Benzena bersifat nonpolar karena tidak mempunyai PEB
· Benzena tidak berwarna, berbau khas (sifat aromatik), dan mudah menguap
· Karena bersifat nonpolar, kelarutannya semakin kuat pada pelarut nonpolar, tetapi berkurang dalam pelarut polar seperti air.
· Titik leleh dan didih benzena rendah
· Benzena tidak reaktif, tetapi mudah terbakar dan menghasilkan banyak jelaga
· Densitas : 0,88
3. Sifat Kimia Benzena
Berikut ini adalah sifat Kimia yang di miliki Benzena:
· Bersifat toksik dan sedikit karsinogenik (bersifat menimbulkan kanker)
· Benzena tidak dapat dioksidasi oleh Br, air, dan KMnO4
· Benzena lumayan mudah diadisi oleh H2 dan Cl2 saja tetapi dengan bantuan katalis nikel (Ni) dan sinar matahari
· Atom-atom H pada benzena dapat digantikan (disubstitusi) oleh atom lain sehingga menghasilkan turunan benzena
· Turunan benzena dapat bereaksi dengan turunan alkana sehingga membentuk suatu rantai kimia yang panjang (tergantung banyaknya atom C pada turunan alkana)
· Lebih mudah mengalami reaksi substitusi dari pada adisi.
4. Reaksi-reaksi Benzena
· Reaksi Nitrasi
· Reaksi Sulfonasi
· Alkilasi Benzena
· Reaksi halogenasi
· Reaksi Friedel-Crafts
b. Resonansi
Resonansi adalah delokalisasi elektron pada molekul atau ion poliatomik tertentu dimana ikatannya tidak dapat dituliskan dalam satu struktur Lewis. Struktur molekul atau ion yang mempunyai delokaliasi elektron disebut dengan struktur resonan. Masing-masing struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu ikatan kovalen antara masing-masing pasangan atom. Beberapa struktur Lewis digunakan bersama-sama untuk menjelaskan struktur molekul. Namun struktur tersebut tidak tetap, melainkan ada sebuah osilasi antara ikatan rangkap dengan elektron, saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah peralihan dari dua struktur resonan. Bentuk peralihan (intermediet) dari struktut resonan disebut dengan hibrida resonan.
Resonansi adalah delokalisasi elektron pada molekul atau ion poliatomik tertentu dimana ikatannya tidak dapat dituliskan dalam satu struktur Lewis. Struktur molekul atau ion yang mempunyai delokaliasi elektron disebut dengan struktur resonan.
Resonansi secara singkat dapat dikatakan dengan suatu molekul yang strukturnya sama tetapi konfigurasi elektronnya berbeda. Masing-masing struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu ikatan kovalen antara masing-masing pasangan atom. Beberapa struktur Lewis digunakan bersama-sama untuk menjelaskan struktur molekul. Namun struktur tersebut tidak tetap, melainkan ada sebuah osilasi antara ikatan rangkap dengan elektron, saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah peralihan dari dua struktur resonan. Bentuk peralihan (intermediet) dari struktut resonan disebut dengan hibrida resonan.
Hal yang harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya merupakan gabungan dari semua struktur resonansinya. Hal ini pun berlaku dalam struktur resonansi benzena, sehingga benzena lebih sering digambarkan sebagai berikut:
Teori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya
Resonansi dalam kimia diberi simbol garis dengan dua arah panah (↔).contoh menggambarkan dengan jelas mengenai resonansi adalah struktur benzen. Benzen memiliki enam atom karbon ekovalen dan membentuk sutau cincin aromatis. Benzena adalah contoh suatu senyawa organik yang tak dapat digambarkan secara teliti dengan rumus ikatan tunggal. Delokalisasi dari ikatan pi menghasilkan sistem dalam mana elektron pi mencakup lebih dari pada dua atom. Untuk dapat menggambarkan distribusi elektron pi dalam benzena dengan menggunakan rumus ikatan valensi, harus digunakan dua rumus (menurut Kekule), seperti pada gambar di bawah ini.
Kedua struktur Kekule di atas dikatakan ada dalam resonansi yang satu dengan yang lain, dengan kata lain struktur Kekule sebagai lambang resonansi atau struktur resonansi. Lambang struktur resonansi bukan merupakan struktur nyata. Struktur nyata adalah gabungan dari struktur resonansi. Faktor yang mempengaruhi terjadinya resonansi adalah pergeseran elektron yang terdapat dalam senyawa tersebut.
Molekul atau ion yang dapat beresonansi mempunyai sifat-sifat berikut:
· Dapat dituliskan dalam beberapa struktur Lewis yang disebut dengan struktur resonan. Tetapi tidak satupun struktur tersebut melambangkan bentuk asli molekul yang bersangkutan.
· Di antara struktur yang saling beresonansi bukanlah isomer. Perbedaan antar struktur hanyalah pada posisi elektron, bukan posisi inti.
· Masing-masing struktur Lewis harus mempunyai jumlah elektron valensi dan elektron tak berpasangan. yang sama.
· Ikatan yang mempunyai orde ikatan yang berbeda pada masing-masing struktur tidak mempunyai panjang ikatan yang khas.
· Struktur yang sebenarnya mempunyai energi yang lebih rendah dibandingkan energi masing-masing struktur resonan.
Bila suatu struktur merupakan hibrida resonansi dari dua atau lebih struktur resonansi maka energi struktur yang nyata adalah lebih rendah dari setiap struktur resonansi tunggal. Struktur nyata dikatakan distabilkan resonansi. Semakin banyak kemungkinan membentuk struktur resonansi, maka semakin stabil struktur nyata senyawa tersebut. Stabilasi resonansi adalah paling penting bila dua atau lebih struktur resonansi untuk suatu senyawa adalah ekivalen dalam energy.
Suatu struktur resonansi berenergi tinggi dan kecil sumbangannya penambahan stabilisasinya kecil. Alasan dari perbedaan energy antara struktur resonansi hipotetik dan struktur yang nyata dari suatu senyawa tak seluruhnya dimengerti. Tentu sebagian dari alasannya adalah bahwa elektron yang terdelokalisasi ditarik ke lebih dari satu inti. Secara umum adalah benar bahwa sistem dengan delokalisasi electron atau muatan electron adalah berenergi lebih rendah dan kestabilannya lebih besar daripada system dengan electron atau muatan elektron terlokalisasi.
DAFTAR PUSTAKA
http://intanpertiwi12.blogspot.co.id/2015/10/pengertian-orbital.html
http://www.bhataramedia.com/forum/apa-pengertian-orbital-hibrida/
https://www.slideshare.net/Oktyashari/ikatan-kimia-dan-struktur-molekul-60156231
https://wanibesak.files.wordpress.com/2011/06/kimia-organik-i-jilid-1.pdf
http://frandimardiansyah.blogspot.co.id/2016/09/kimia-organik-i_68.html
Permasalahan : Bagaimana cara mengidentifikasi perbedaan orbital hibrida nitrogen dan oksigen?
https://wanibesak.files.wordpress.com/2011/06/kimia-organik-i-jilid-1.pdf
http://frandimardiansyah.blogspot.co.id/2016/09/kimia-organik-i_68.html
Permasalahan : Bagaimana cara mengidentifikasi perbedaan orbital hibrida nitrogen dan oksigen?











Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3. Mengapa demikian?
BalasHapusAtom nitrogen memiliki konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen. Nitrogen memiliki tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena. Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
HapusIkatan sigma terbentuk dari overlap orbital hibrida sp3 yang tidak berpasangan tersebut dengan orbital 1s dari hidrogen menghasilkan molekul ammonia. Dengan demikian, ammonia memiliki bentuk geometri tetrahedral yang mirip dengan metana.
Ketika satu elektron dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2
Elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi sp).
mengapa dalam menulis struktur resonansi,kita hanya boleh memindahkan elektron?
BalasHapusDalam menulis struktur resonansi, kita hanya boleh memindahkan elektron, sedangkan posisi inti atom tetap seperti dalam molekulnya. Hal ini dikarenakan resonansi adalah delokalisasi elektron pada molekul atau ion poliatomik tertentu dimana ikatannya tidak dapat dituliskan dalam satu struktur Lewis. Struktur molekul atau ion yang mempunyai delokaliasi elektron disebut dengan struktur resonan. Resonansi secara singkat dapat dikatakan dengan suatu molekul yang strukturnya sama tetapi konfigurasi elektronnya berbeda. Faktor yang mempengaruhi terjadinya resonansi adalah pergeseran elektron yang terdapat dalam senyawa tersebut dan bukan yang lainnya. Itulah alasan mengapa dalam menulis struktur resonansi, kita hanya boleh memindahkan elektron saja.
Hapussaya ingin menambahkan Orbital anti-ikatan selalu ditunjukan dengan tanda bintang pada simbolnya. Perhatikan, ketika orbital ikatan terbentuk, energinya menjadi lebih rendah daripada energi orbital atom asalnya (sebelum berikatan). Energi dilepaskan ketika orbital ikatan terbentuk, dan molekul hidrogen lebih stabil secara energetika daripada atom-atom asalnya. Sedangkan, suatu orbital anti-ikatan adalah kurang stabil secara energetika dibanding atom asalnya. Stabilnya orbital ikatan adalah karena adanya daya tarik-menarik antara inti dan elektron. Dalam orbital anti-ikatan daya tarik-menarik yang ada tidak ekuivalen – sebaliknya, anda akan mendapatkan tolakan. Sehingga peluang menemukan elektron diantara dua inti sangat kecil – bahkan ada bagian yang tidak mungkin ditemukan elektron diantara dua inti tersebut. Sehingga tak ada yang menghalangi dua inti untuk saling menolak satu sama lain.
BalasHapus1. Setiap orbital (molekul atau atom ) dapat memegang maksimum dua elektron, yang harus mempunyai spin berlawanan.
2. Jumlah oerbital molekul sama dengan orbital atom yang digunakan dalam pembentukannya.
3. Dalam pengisian orbital molekul dengan elektron, orbital berenergi terendah diisi dahulu. Bila dua orbital terdegenerasi (dari energi yang sama), masing-masing mendapat satu elektron sebelum salah satu orbital terisi penuh).
Apa yg terjadiBila suatu struktur merupakan hibrida resonansi dari dua atau lebih struktur resonansi
BalasHapusBila suatu struktur merupakan hibrida resonansi dari dua atau lebih struktur resonansi, energy struktur yang nyata adalah lebih rendah dari pada setiap struktur resonansi tunggal. Struktur nyata dikatakan distabilkan-resonansi. Dalam kebanyakan hal, perbedaan energy kecil, tetapi untuk system aromatic, seperti benzene atau naftalena, perbedaan energinya berarti.
Hapus