Orbital dan Peranannya dalam Ikatan Kovalen
ORBITAL DAN PERANANNYA DALAM IKATAN KOVALEN
A. SIFAT GELOMBANG
Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan prinsip ketidakpastian yaitu “Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom”.
Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan
elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan
oleh Erwin Schrodinger.Erwin
Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi
gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron
dalam tiga dimensi.
Model atom dengan orbital lintasan elektron ini disebut model atom
modern atau model atom mekanika kuantum yang berlaku sampai saat ini,
seperti terlihat pada gambar berikut ini.

Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron.
Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan
tingkat energi yang sama atau hampir sama akan membentuk sub kulit.
Beberapa sub kulit bergabung membentuk kulit.Dengan demikian kulit
terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa
orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum
tentu sama.
CIRI KHAS MODEL ATOM MEKANIKA GELOMBANG
- Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
- Bentuk dan ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut)
- Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang pasti, tetapi bolehjadi merupakan peluang terbesar ditemukannya elektron
Dualisme cahaya diterapkan oleh
de Broglie terhadap elektron yang bergerak mengelilingi inti. Sifat gelombang
dari elektron ini kemudian mengakibatkan adanya ketaktentuan dari kedudukan
elektron sekeliling inti, yang diterangkan berdasarkan Prinsip Ketaktentuan
dari Heisenberg.Dengan dasar gerak gelombang dari elektron, Schrodinger
kemudian menurunkan persamaan gelombang berdasarkan mekanika gelombang. Dalam
penurunan persamaannya, maka koordinat Cartes yang umum digunakan untuk menggambarkan
materi dalam tiga dimensi, diubah menjadi koordinat polar. Penyelesaiannya
menghasilkan suatu fungsi gelombang yang terdiri dari fungsi sudut dan fungsi
radial. Kedua fungsi tersebut mempunyai arti fisik.
Dengan persamaan Schrodinger dapat diturunkan pula
tingkat-tingkat energi serta bilangan kuantum bagi elektron. Dengan menggunakan
Prinsip Eksklusi dari Pauli, setiap elektron dalam masing-masing tingkat energi
dapat diterangkan dengan menggunakan Prinsip Aufbau.Dasar teori kuantum dapat
digunakan pula untuk menerangkan struktur dari Susunan Berkala dan demikian
pula menerangkan keperiodikan dari sifat fisik dan kimia dari unsur-unsur.Transisi
antara tingkat-tingkat energi berlangsung dalam radiasi elektromagnetik dari
absorpsi maupun emisi. Aturan transisi ini akan dibahas dalam spektrum atom.
Konsep kebolehjadian dapat
diterapkan pada pola difraksi elektron. cincin-cincin difraksi adalah daerah
dengan kebolehjadian yang tinggi. Rapat elektron berbanding lurus dengan
kuadrat faktor amplitudo yang didapat dari persamaan gelombang. Sifat khas
gerak gelombang adalah kemampuannya untuk meneruskan energi dari satu titik ke
titik lain tanpa perpindahan permanen dari mediumnya. Gelombang ini disebut gelombang
progresif (Sebuah gelombang yang memindahkan energi dari satu bagian dari media lain).
Suatu persamaan gelombang dinyatakan sebagai
berikut:
∂2/∂x2 = 1/c2 ∂2ϕ/∂r2
(2-6)
dimana ϕ = a sin 2π (x/λ – vt), v adalah frekuensi,
a adalah nilai maksimum dari amplitudo, c adalah kecepatan perambatan. Persamaan
(2-6) adalah linier, maka dengan Prinsip Superposisi dua persamaan
dengan ϕ1 dan ϕ2 dapat dikombinasi linier. Untuk
gelombang ϕ1 dan ϕ2:
∂2ϕ1/∂x2 = 1/c2
∂2ϕ2/∂t2 dan ∂2ϕ2/∂x2
= 1/c2 ∂2ϕ2/∂t2
Kombinasi linier menghasilkan:
∂2(a1ϕ1 + a2ϕ2)/
∂x2 = a1 ∂2ϕ1/∂x2 + a2
∂2ϕ2/∂x2
= 1/c2 {a1 ∂2ϕ1/∂t2
+ a2 ∂2ϕ2/∂t2} = 1/c2 ∂2(a1ϕ1
+ a2ϕ2)/ ∂x2
(2-7).
Prinsip superposisi ini sekarang digunakan untuk
vibrasi tali gitar antara dua titik tertentu atau dua titik mati. Untuk
gelombang progresif dari kiri ke kanan persamaan gelombangnya:
ϕ1 = a sin 2π (x/λ – vt)
(2-8)
setelah mencapai ujung, gelombang direfleksi dan
berjalan kembali dari kanan ke kiri dengan persamaan gelombang:
ϕ2 = a sin 2π (x/λ – vt)
(2-9)
Gerak gelombang total dinyatakan dengan persamaan:
ϕ = ϕ1 + ϕ2 = a sin 2π (x/λ –
vt) + a sin 2π (x/λ + vt) (2-10).
Untuk gelombang tegak atau gelombang
stasioner, bila ϕ = 0, maka sin 2π x/λ = 0, yaitu bila:
2πx/λ = nπ dan x =
nλ/2
(2-11).
n ialah bilangan bulat.
Gelombang stasioner dapat menggambarkan gerak
gelombang dari elektron sekeliling inti dalam atom. Agar terjadi interferensi
konstruktif dari gelombang de Broglie dengan elektron dalam lintasan Bohr, maka
harus dipenuhi hubungan:
2πr =
nλ
(2-12).
Substitusi persamaan (2-3) ke dalam persamaan
(2-12) menghasilkan:
Mvr = n h/2π; n = 1, 2, 3,
… (2-13). n ialah bilangan kuantum utama
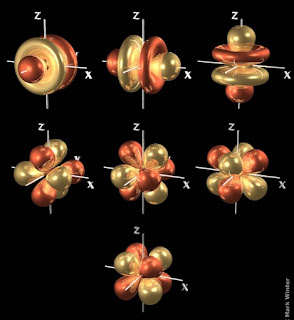
BENTUK-BENTUK ORBITAL

Setiap subkulit disusun oleh satu atau lebih orbital dan setiap orbital mempunyai bentuk tertentu. Adapun bentuk oebital di tentukan oleh bilangan kuantum azimut.Perhatikan gambar bentuk-bentuk orbital berdasarkan harga l (bilangan kuantum azimut).

Orbital
s yang berbentuk bola tidak menunjukan arah ruang tertentu karena
kebolehjadian ditemukan elektron dengan bentuk ini berjarak sama jauhnya
ke segala arah dari inti atom.
Inti atom terdapat pada pusat bola. Perhatikanlah gambar arah ruang orbital s berikut ini

Kebolehjadian terbesar ditemukannya elektron dalam orbital s terdapat pada daerah sekitar bola, yaitu untuk orbital :
a. 1s : terdapat pada kulit bola
b. 2s : terdapat pada awan lapisan kedua
c. 3s : terdapat pada awan lapisan ketiga
Gambaran kebolehjadian ditemukan orbital pada masing-masing kulit :

Subkulit
p terdiri dari tiga orbital p. Karena nilai bilangan kuantum
magnetiknya ada tiga yaitu –1, 0, dan +1. Ketiga orbital ini mempunyai
tingkat energi yang sama tetapi arah ruangnya masing-masing berbeda.
Jika digabungkan, ketiga orbital ini saling tegak lurus satu sama lain.
Bila digambarkan pada sistem koordinat kartesius yang memiliki sumbu X,
Y, dan Z maka orbital p yang terletak pada sumbu X disebut orbital px,
sedangkan yang terletak pada sumbu Y disebut orbital py. Begitu pula
halnya dengan orbital p yang terletak pada sumbu Z disebut orbital pz,
perhatikan gambar berikut ini!
Sehingga gambaran orbital p dengan bilangan kuantum azimut l =1 dinyatakan dalam gambar berikut ini!

Untuk
mengambarkan orbital atom p, ambillah 3 buah balon. Kemudian pilin
(putar) pada bagian tengah balon. Lakukan hal ini pada semua balon.
Siapkan tali pengikat yang akan digunakan untuk menggabungkan ketiga
balon. Balon pertama diletakkan tegak lurus (vertikal), sedangkan balon
kedua diletakkan mendatar (horisontal), dan balon ketiga diletakkan
diantara balon pertama dan balon kedua. Bagian balon yang dipilin harus
berada di tengah-tengah ikatan dari ketiga balon yang diikat menjadi
satu. Pastikan bahwa ketiga balon ini terikat dengan kuat.
Subkulit
d terdiri dari 5 orbital d karena nilai bil kuantum magnetiknya –2,
-1, 0, +1, +2. Seperti halnya orbital p, orbital d juga memiliki
tingkat energi yang sama tetapi arah ruangnya masing-masing berbeda.
Bila digambarkan pada sistem koordinat kartesius maka ketiga orbital d
menempati ruang antar sumbu pada koordinat kartesius tersebut.
Masing-masing orbital dinyatakan sebagai dXY, dXZ dan dYZ, sedangkan dua orbital d lainnya terletak pada sumbu koordinat kartesius yang masing-masing orbital dinyatakan sebagai dX2-Y2 dan dZ2. Bentuk kelima orbital d dapat digambarkan sebagai berikut:

Orbital dZ2 terletak pada sumbu Z
Orbital dX2-Y2 terletak pada sumbu X dan Y
Orbital dXY terletak antara sumbu X dan Y
Orbital dXZ terletak antara sumbu X dan Z
Orbital dYZ terletak antara sumbu Y dan Z
Untuk
menggambarkan orbital d yaitu : pada orbital d mempunyai 4 orbital
dengan bentuk seperti 2 balon terpilin yaitu dxy, dxz, dyz dan dx2-y2 dengan satu bentuk orbital yang berbeda yaitu orbital dz2.
Sedangkan orbital f memiliki 7 obital seperti yang digambarkan sebagai berikut:


Dalam
pengambaran orbital atom akan semakin rumit, sebagai contoh
penggambaran orbital atom pada atom-atom yang no atomnya kecil seperti
atom Li, Be, B dan C adalah sebagai berikut :


DAFTAR PUSTAKA
https://windipujiwati.wordpress.com/2016/09/10/teori-atom-mekanika-kuantum/
http://nitasarii.blogspot.co.id/2016/09/orbital-dan-peranannya-dalam-ikatan.html
http://bozzkaf.blogspot.co.id/2013/08/bentuk-bentuk-orbital-s-p-d-dan-f.html
https://www.google.com/search?q=BENTUK-BENTUK+ORBITAL&client=firefox-b-ab&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjdrc7JtuXVAhVGYo8KHcguAWUQ_AUICigB&biw=1366&bih=639#imgrc=fDXQerF652v7XM:
http://id.termwiki.com/ID/progressive_wave
http://chemistry35.blogspot.co.id/2011/04/orbital-ikatan-dan-anti-ikatan-dalam.html
http://imelledis.blogspot.co.id/2016/09/orbital-hibridisasi.html
Permasalahan : Mengapa bentuk orbital ditentukan oleh bilangan kuantum azimut?
http://nitasarii.blogspot.co.id/2016/09/orbital-dan-peranannya-dalam-ikatan.html
http://bozzkaf.blogspot.co.id/2013/08/bentuk-bentuk-orbital-s-p-d-dan-f.html
https://www.google.com/search?q=BENTUK-BENTUK+ORBITAL&client=firefox-b-ab&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjdrc7JtuXVAhVGYo8KHcguAWUQ_AUICigB&biw=1366&bih=639#imgrc=fDXQerF652v7XM:
http://id.termwiki.com/ID/progressive_wave
http://chemistry35.blogspot.co.id/2011/04/orbital-ikatan-dan-anti-ikatan-dalam.html
http://imelledis.blogspot.co.id/2016/09/orbital-hibridisasi.html
Permasalahan : Mengapa bentuk orbital ditentukan oleh bilangan kuantum azimut?








assamuallaikum..bagaimana cara menentukan posisi dari suatu elektron?
BalasHapusWa'alaikumsalaam,
HapusSusunan Elektron dalam Atom dapat dijelaskan menggunakan konfigurasi elektron. Penyusunannya dalam Atom didasarkan pada teori-teori tertentu yaitu diantaranya adalah Teori Dualisme Gelombang Partikel, Azas ketidakpastian, dan Teori Persamaan Gelombang. Teori Dualisme gelombang partikel yang dikemukaan oleh De Broglie pada tahun 1924, teori ini menyatakan elektron dalam atom bersifat gelombang dan partikel.
Azas Ketidakpastian yang dikemukakan oleh Heisenberg pada tahun 1927, menyatakan bahwa posisi dan momentum partikel tidak dapat ditentukan secara pasti dalam waktu bersamaan. Teori ini menyimpulkan bahwa lintasan elektron tidak berbentuk lingkaran. Dan Teori Persamaan Gelombang yang diemukakan oleh Erwin Schrodinger, menerangkan bahwa pergerakan partikel-partikel mikroskopik termasuk Elektron.
Azas Ketidakpastia menurut Heisenberg, menyebabkan posisi elektron tidak ditentukan dengan pasti demikian pula dengan elektron dalam atom menurut Mekanika Kuantum. Walaupun orbit elektron tidak dapat ditentukan dengan pasti, tetapi peluang untuk menentukan elektron pada posisi tertentu disekitar inti masih mungkin untuk ditentukan. Orbital merupakan daerah disekitar inti dengan peluang terbesar untuk menetukan elektron. Kapasitas maksimal orbital untuk ditempati elektron sebesar 2 elektron. Orbital juga ini sering disebut tingkat energi. Hanya elektron dengan energi yang cocok dapt menempati orbital tersebut.
Elektron mempunyai jumlah maksimum dalam kulit tertentu sebesar 2n2 dengan ( n ) adalah Nomor Kulit. Pengisian Elektron dimulai pada kulit, dengan tingkat energi terendah yaitu kulit pertama atau ( K ) yang dilanjutkan dengan kulit L, M N dan seterusnya. Pengisian dilakukan dengan maksimum terlebih dahulu untuk tiap kulit, karna apabila 18 elektron maka elektron akan mengisi kulit K sebanyak dua yang dilanjutkan dengan pengisian kulit L sebanyak 8 elektron dan diakhiri dengan kulit L pula sebanyak 8 elektron.
Elektron Valensi merupakan jumlah elektron yang terdapat pada kulit terluar suatu Atom Unsur. Ikatan kimia dapat terbentuk dengan memanfaatkan atau menggunakan Elektron Valensi sehingga Elektron Valensi dapat dikatakan suatu penentu sifat imia Atom Unsur.
Bilangan Kuantum
Menggunakan mekanika gelombang, pada setiap elektron dalam Atom dicirikan dengan 4 prameter yang disebut bilangan kuantum. yaitu :
Kulit dinyatakan dengan bilangan kuantum utama (n). Terkadang ditandai dengan hrup K, L, M, N, O dsb. n = 1, 2, 3, 4, ….. Bilangan ini berhubungan dengan jarak elektron dari inti.
Sub kulit dinyatakan dengan ( I ), ditandai dengan hurup kecil s, p, d, , f.
Sub kulit dinyatakan dengan ( ml ). Jika sub kulit s : Jumlah tingkat energi 1, jika p : jumlah tingkat energinya 3, jika d : jumlah tingkat energinya 5, dan jika f : jumlah energinya 7.
Momen spin arah atas atau bawah (ms), bernilai +1/2 dan -1/2
Assalamu'alaikum
BalasHapusTerima kasih informaainya
Saya ingin bertanya,, tolong anda jelaskan apa yang dimaksud dengan hibridisasi dan untuk apa teori ini sering digunakan??
Wa'alaikumsalaam, Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling[2] dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik. Teori hibridisasi sering digunakan dalam kimia organik, biasanya digunakan untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
HapusHibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedal (seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat dengan 4 atom hidrogen. Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat. orbital-orbital keadaan dasar tidak bisa digunakan untuk berikatan dalam CH4. Walaupun eksitasi elektron 2s ke orbital 2p secara teori mengizinkan empat ikatan dan sesuai dengan teori ikatan valensi (adalah benar untuk O2), hal ini berarti akan ada beberapa ikatan CH4 yang memiliki energi ikat yang berbeda oleh karena perbedaan aras tumpang tindih orbital. Gagasan ini telah dibuktikan salah secara eksperimen, setiap hidrogen pada CH4 dapat dilepaskan dari karbon dengan energi yang sama. katan kimia dalam senyawa seperti alkuna dengan ikatan rangkap tiga dijelaskan dengan hibridisasi sp.
Dalam kimia, hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom.
Orbital adalah sebuah model representasi dari tingkah laku elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana, pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi. Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia adalah salah satu dari sedikit orbital yang persamaan Schrödingernya memiliki penyelesaian analitis yang diketahui. Orbital-orbital ini kemudian diasumsikan terdistorsi sedikit untuk atom-atom yang lebih berat seperti karbon, nitrogen, dan oksigen. Dengan asumsi-asumsi ini, teori hibridisasi barulah dapat diaplikasikan.
Hibridasi
Perhatikan konfigurasi elektron Be, B dan C
Be : 1s2 2s2
B : 1s2 2s2 2p1
C : 1s2 2s2 2p2
Berilium dapat membentuk senyawa yang bersifat kovalen seperti BeH2 dan BeCl2. Boron dapat membentuk senyawa dengan perbandingan 1:3 seperti BF3 dan BCl3.
Pada senyawa karbon yang lebih dari sejuta banyaknya dapat dijumpai atom karbon yang terikat melalui empat pasangan elektron ikatan.
Jika ditinjau dari konfigurasi elektron saja, maka dapat diduga bahwa, berilium yang orbitalnya terisi penuh tidak dapat membentuk satu ikatan kovalen, sedangkan karbon hanya dapat membentuk dua ikatan kovalen.
Kontradiksi antara pengamatan eksperimen dan ramalan berdasarkan model atom, menunjukkan bahwa model orbital atom masih jauh dari sempurna untuk menjelaskan ikatan kimia.
Oleh sebab itu, penyusunan elektron dalam orbital setiap bilangan kuantum utama perlu ditata kembali. Penyusunan kembali orbital dalam sebuah atom, untuk membentuk seperangkat orbital yang ekivalen dalam molekul disebut hibridisasi.
kenapa orbital atom yang membentuk orbital molekul harus mempunyai energi yang harus dibandingkan
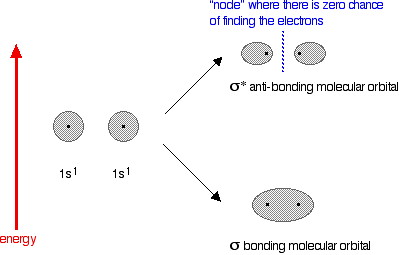
BalasHapusSifat simetri dan energi relatif orbital atom menentukan bagaimana mereka berinteraksi untuk membentuk orbital molekul. Orbital molekul ini kemudian diisi dengan elektron tersedia sesuai dengan aturan yang sama yang digunakan untuk orbital atom, dan energi total elektron dalam orbital molekul dibandingkan dengan total awal energi elektron dalam orbital atom.
BalasHapusJika energi total elektron dalam molekul orbital kurang dari dalam orbital atom, molekul stabil dibandingkan dengan atom; jika tidak, molekul tidak stabil dan senyawa tidak terbentuk. Kami akan pertama menggambarkan ikatan (atau kurangnya itu) di sepuluh pertama molekul diatomik homonuclear dan kemudian memperluas pengobatan untuk heteronuklir molekul diatomik dan molekul yang memiliki lebih dari dua atom.
selamat siang marta , postingan yang menarik ,izinkan saya menambahkan sedikit materi blog saudari tentang sifat gelombang bahwa Meskipun sistem gelombang tiga dimensi lebih rumit daripada sistem satu dimensi namun, prinsipnya sama. Masing-masing orbital atom dari atom berkelakuan seperti fungsi gelombang dan dapat mempunyai amplitudo positif atau negatif. Bila orbital mempunyai amplitudo positif dan negatif maka orbital mempunyai simpul. Satu satu orbital atom dapat bertumpang tindih dengan orbital atom dari atom lain secara matematik, fungsi gelombang yang menggambarkan setiap orbital yang tumpang tindih dijumlahkan bersama.
BalasHapusBaik, terima kasih atas tambahannya, agar postingan selanjutnya bisa lebih baik lagi.
HapusApa syarat sebuah senyawa aromatis?
BalasHapusYang termasuk senyawa aromatis syaratnya adalah:
BalasHapus1. Molekul harus siklik dan datar.
2. Memiliki orbital p yang tegak lurus pada bidang cincin (memungkinkan terjadinya delokalisasi elektron pi) bila tidak , tidak mungkin terjadi delakolasi penuh electron Phi.
3. Memiliki elektron pi = 4n + 2 (aturan Huckle) n = bilangan bulat.
Yang termasuk senyawa aromatis syaratnya adalah:
BalasHapus1. Molekul harus siklik dan datar.
2. Memiliki orbital p yang tegak lurus pada bidang cincin (memungkinkan terjadinya delokalisasi elektron pi) bila tidak , tidak mungkin terjadi delakolasi penuh electron Phi.
3. Memiliki elektron pi = 4n + 2 (aturan Huckle) n = bilangan bulat.